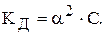Кількісні характеристики процесу дисоціації
· Ступінь дисоціації (a) - відношення кількості молекул, що розпалися на іони до загальної кількості молекул електроліту, що розчинили в розчині. Вимірюється в долях одиниці чи у відсотках.
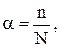
де n - кількість молекул, що розпалися на іони,
N - загальна кількість молекул електроліту.
Електроліти підрозділяють на сильні та слабкі. Якщо a=1 чи a=100%, електроліт вважають сильним. Якщо a<0,03 чи a<3%, електроліт вважають слабким.
Сильні електроліти: а) кислоти (HCl, HBr, HI, H2SO4, HNO3, HClO4…);
б) основи (LiOH, KOH, NaOH, Ba(OH)2, Ca(OH)2…);
в) усі солі, що розчиняються у воді.
· Константа дисоціації (Кд) - константа рівноваги процесу дисоціації. Константа характеризує процес дисоціації слабких електролітів. Наприклад, для одноосновної слабкої кислоти процес дисоціації можна записати так:
КАÛК++А- .
Відповідно константа дисоціації буде дорівнювати:
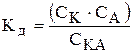 ,
,
де  - концентрація катіону, моль/л;
- концентрація катіону, моль/л;
 - концентрація аніону, моль/л;
- концентрація аніону, моль/л;
 - концентрація кислоти, моль/л.
- концентрація кислоти, моль/л.
Багатоосновні кислоти та гідроксиди двох- і більш валентних металів дисоціюють за ступенями.
Закон розведення Оствальда:

де  - ступінь дисоціації,
- ступінь дисоціації,
 - концентрація електроліту, моль/л.
- концентрація електроліту, моль/л.
Для слабкого електроліту закон має вигляд: