Дисоціація води
Реакції, які застосовують в аналітичній хімії перебігають найчастіше у водних розчинах. Вода - слабкий електроліт, який іонізується згідно з рівнянням:
Н2О®Н++ОН-.
Оскільки з кожної молекули під час іонізації утворюється по одному іону Н+ та ОН-, концентрації їх у чистій воді однакові: [Н+]=[ОН-]=10-7 моль/л (при 25°С). Процес розпаду можна охарактеризувати відповідною константою:
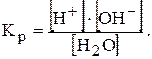
Кр×[Н2О]=[Н+]×[ОН-]=КW - іонний добуток води
За температури 25°С КW=10-7×10-7=10-14=const. Якщо [Н+]=[ОН-]=10-7 розчин називають нейтральним. Якщо [Н+]>10-7 >[ОН-] розчин називають кислим. Якщо [Н+]<10-7 <[ОН-] розчин називають лужним.
Реакцію будь-якого розчину можна охарактеризувати кількісно, вказавши, яка в ньому концентрація гідроген-іонів. Замість концентрації гідроген-іонів краще користуватись від’ємним логарифмом цієї величини, який називають водневим показником та позначають знаком рН:
рН=-lg[Н+].
Якщо рН=7 середовище називають нейтральним. Якщо рН>7 середовище називають лужним. Якщо рН<7 середовище називають кислим.
Поряд із водневим показником часто застосовують гідроксильний показник рОН: