Кількісні характеристики процесу гідролізу
Кількісно процес гідролізу характеризується ступенем гідролізу (α) та константою гідролізу (Кгідр).
Ступінь гідролізу, тобто мольна доля електроліту, яка піддається гідролізу (у %), залежить від природи солі, температури та концентрації розчину. Розведення розчину та нагрівання збільшують ступінь гідролізу.
Константою гідролізу називають перетворену константу рівноваги реакції гідролізу. Наприклад, для реакції гідролізу етаноат-іона:
CH3COO-+ H2O ®CH3COOH+OH-.
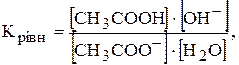
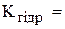
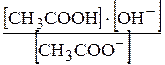 .
.
Для малодисоційованих розчинів [Н2О]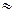 const, тому Крівн×[Н2О]=const=Кгідр. Шляхом перетворень можна виразити Кгідр через величини константи дисоціації слабкої кислоти, яка утворюється в результаті гідролізу (Ккисл) та іонного добутку води.
const, тому Крівн×[Н2О]=const=Кгідр. Шляхом перетворень можна виразити Кгідр через величини константи дисоціації слабкої кислоти, яка утворюється в результаті гідролізу (Ккисл) та іонного добутку води.
Замінивши через іонний добуток води (Кw) концентрацію гідроксид-іонів
[ОН-]=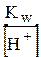 , отримують вираз Кгідр. для випадку гідролізу за аніоном:
, отримують вираз Кгідр. для випадку гідролізу за аніоном:
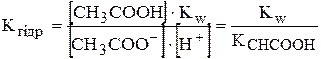 ;
; 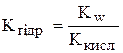 .
.
Аналогічно за катіоном: 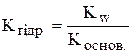 .
.