Теоретичні умови осадження малорозчинних сполук
Під час аналізу використовують не тільки гомогенні, але й гетерогенні системи. Наприклад, система, яка складається з насиченого розчину, що торкається з осадом відповідної речовини. Окремі частини гетерогенної системи, які розділені поверхнями розподілу, називаються її фазами. Таким чином, осад та насичений розчин ¾ це різні фази гетерогенної системи. Під час виконання аналітичних операцій, таких як, осадження чи відділення іонів, промивання та розчинення осадів, мають справу з гетерогенними системами.
Розглянемо малорозчинний електролыт під час його зіткнення з водою. Кристалічна градка барій сульфату утворена барій(ІІ)-катіонами та сульфат-аніонами, які у процесі розчинення під дією диполей води переходять з поверхні кристалів у розчин. Одночасно з процесом розчинення почнеться і зворотній процес ¾ осадження барій сульфату. Поступово швидкість процесу розчинення речовини зменщується, а швидкість протилежного процесу ¾ осадження ¾ збільшується , що призводить до стану динамічної рівноваги. До насиченого розчину, як до рівноважної системи, застосуємо закон діючих мас. Якщо швидкість процесу розчинення 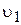 показує кількість барій(ІІ)-катіонів та сульфат-аніонів, що уходять за певний час з поверхні твердої фази у розчин, то швидкість повинна бути прямопропорційна числу цих іонів на одиниці поверхні. Однак, при зменшенні загальної кількості твердої фази розташування іонів на її поверхні залишається незмінним. Тому можна припустити, що швидкість розчинення твердої фази залишається постійною і дорівнює величині k1
показує кількість барій(ІІ)-катіонів та сульфат-аніонів, що уходять за певний час з поверхні твердої фази у розчин, то швидкість повинна бути прямопропорційна числу цих іонів на одиниці поверхні. Однак, при зменшенні загальної кількості твердої фази розташування іонів на її поверхні залишається незмінним. Тому можна припустити, що швидкість розчинення твердої фази залишається постійною і дорівнює величині k1
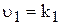 .
.
Швидкість протилежного процесу ¾ осадження ¾ 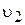 визначається числом зіткнень барій(ІІ)-катіонів та сульфат-аніонів з одиницею поверхні кристалів барій сульфату за той самий час.
визначається числом зіткнень барій(ІІ)-катіонів та сульфат-аніонів з одиницею поверхні кристалів барій сульфату за той самий час.

У насиченому розчині швидкості обох процесів однакові:

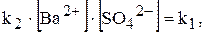

Відношення двох постійних величин  є величина постійна, яку позначають через ДР(BaSO4):
є величина постійна, яку позначають через ДР(BaSO4): 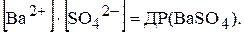
Величина ДР кількісно характеризує властивість електроліту розчинятись і називається добутком розчинності. Як би не змінювались концентрації окремих іонів у насиченому розчині малорозчинного електроліту, добуток їх (за умови сталості температури) залишається постійною величиною.
У загальному випадку малорозчинний електроліт дисоціює за рівнянням:

Правило добутку розчинності одержує такий матиматичний вираз:
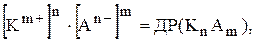
де 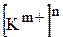 та
та 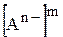 ¾ рівноважні концентрації катіонів та аніонів, що утворюються підчас дисоціації електроліту
¾ рівноважні концентрації катіонів та аніонів, що утворюються підчас дисоціації електроліту 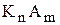 ;
;
n, m ¾ степені, у які необхідно звести концентрації іонів.
Для більш точного розрахунку добутків розчинності слід використовувати не тільки концентарції іонів малорозчинної сполуки, а також їх активності, тому що у розчині електроліту діють міжіонні сили. Якщо враховувати ці сили, то вираз для добутку концентрації барій сульфату буде мати вигляд:
ДР(BaSO4)=a(Ba2+)a(SO42-) чи ДР(BaSO4)=[Ba2+]×[SO42-]×f (Ba2+)f(SO42-),
де a(Ba2+) та а(SO42-) ¾ активності барій(ІІ)-катіонів та сульфат-аніонів,
f (Ba2+) та f(SO42-) ¾ коефіцієнти активності цих іонів.