Вплив пропілпарагідроксибензоату на склад коротколанцюгових жирних кислот у вмістимому товстої кишки білих щурів
Важливе значення у взаємовідносинах макроорганізм - мікробоценоз має обмін низькомолекулярними метаболітами, що утворюються представниками аутохтонної мікрофлори, зокрема КЖК [11, 23, 31,].
В даний час проводять дослідження ролі КЖК у розвитку та прогресуванні патологій шлунково-кишкового тракту, а також локального і системного впливу низькомолекулярних метаболітів на організм людини [4, 55, 61]. Механізми цього впливу залишаються до кінця нез’ясованими.
Широкого поширення набув метод газохроматографічного дослідження КЖК у різних біологічних субстратах [46, 70], що має великі перспективи для діагностики мікроекологічних порушень. Метод має високу роздільну здатність, низьку собівартість дослідження та значну швидкість одержання інформації. Можливо, що він стане ефективним тест-контролем впливу антимікробних речовин та інших негативних чинників на мікрофлору кишечника.
Було проведено якісне та кількісне визначення КЖК у вмістимому товстої кишки білих щурів (рис.3.1).

Рис. 3.1. Хроматограма розділення коротколанцюгових жирних кислот вмістимого товстого кишечника білих щурів
Хроматографічне розділення КЖК вмістимого товстого кишечника, виходячи з даних літератури, дає можливість спрогнозувати зміни співвідношення окремих груп мікроорганізмів за характерною групою КЖК, які вони продукують [46]. Методика газохроматографічного розділення КЖК є високоефективною та достовірною, оскільки піки досліджуваних жирних кислот є віддаленими і не накладаються.
Для отримання кількісних даних проводили калібрування результатів хроматографічних досліджень методом внутрішнього нормування [48].
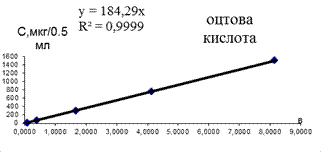
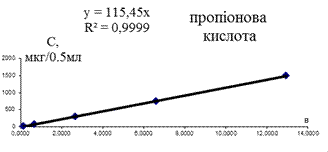
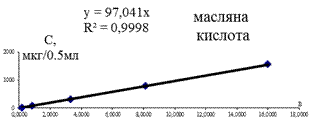
Лінійність (коефіціент кореляції) для калібрувальних графіків (наведених на рис. 3.2) більше 0,99. Це свідчить про практично стовідсоткову достовірність кількісного визначення абсолютного вмісту КЖК.
Двократне введення досліджуваної проби у випарювач хроматографа показало достовірність методики та стабільність досліджуваного показника.
Дослідження абсолютного вмісту КЖК показало (табл. 3.4), що кількість жирних кислот у вмістимому кишечника дослідних щурів відрізняється порівняно з такою в інтактних тварин. Абсолютні концентрації КЖК змінюються наступним чином: контрольна група →7-й день введення →14-й день введення →21-й день (7-й день після припинення введення розчину консерванту).
| 
|
| 
|

| 
|
Рис. 3.2. Калібрувальні графіки КЖК
Таблиця 3.4
Абсолютний вміст КЖК у вмістимому товстої кишки щурів за впливу пропілпарагідроксибензоату (мг/кг)
| КЖК | Концентрація КЖК, мг/кг | |||
| Контроль | доба | |||
| Оцтова | 5126,54±36,13 | 2049,14±75,14 | 1176,38±131,12 | 5330,25±29,11 |
| Пропіонова | 166,60±5,06 | 676,16±18,55 | 418,32±50,91 | 204,63±18,13 |
| Масляна | 51,06±4,67 | 662,18±16,72 | 330,44±63,30 | 50,01±1,23 |
| Ізовалеріанова | 11,60±0,11 | 64,22±3,50 | 73,72±13,65 | 45,14±1,89 |
| Валеріанова | 16,74±1,08 | 78,16±8,59 | 82,52±5,04 | 30,78±2,36 |
| Капронова | 6,20±0,45 | 5,41±3,70 | 4,86±13,71 | 5,70±5,14 |
Протягом дослідження спостерігається певна динаміка змін кількості КЖК вмістимого товстої кишки білих щурів за перорального введення ніпазолу (рис. 3.3).
Одержані нами результати показали, що на 7 і 14 день експерименту кількість оцтової кислоти зменшується у 2,5 та 4,4 рази, відповідно. На 7 день після припинення введення консерванту цей показник зростає навіть трохи вище рівня, визначеного у контрольних тварин. Із даних літератури відомо [4], що основними продуцентами оцтової кислоти у товстому кишечнику є Bifidobacterium, Lactobacillus, Actinomyces, Ruminococcus. Як показали дослідження складу мікрофлори кишечника (див. табл. 3.2), кількість бактерій родів Bifidobacterium, Lactobacillus під впливом ніпазолу зменшується.
Відмінну динаміку змін кількості виявлено для пропіонової, масляної, валеріанової та ізовалеріанової кислоти. Їх кількість зростає на 7 і 14 дні дослідження і практично повертається на 7 день після припинення введення ніпазолу до вихідного рівня, порівняно з контролем. Основними продуцентами пропіонової кислоти є бактерії родів Veillonella, Propionibacterium, Arachnia, Anaerovibrio; валеріанової, ізовалеріанової - Megasphaera, Clostridium; масляної – Acidaminococcus, Bacteroides, Clostridium, Eubacterium, Lachnospira, Butyrivibrio, Gemmiger, Coprococcus, Fusobacterium [4]. Відповідно до змін окремої жирної кислоти змінюється і чисельність характерних груп мікроорганізмів (див. табл. 3.2).
Показано, що при патологіях кишкового тракту, зокрема діареї відбувається активізація строгих анаеробів - продуцентів пропіонової та масляної кислот. Зміни, що відбуваються можна також пояснити стресовим впливом порушення складу мікрофлори на епітелій кишечника. Відомо, що при стресі відбувається переключення метаболізму колоноцитів з циклу Кребса на анаеробний варіант гліколізу, активацію гексозомонофосфатного шунту. Така зміна стратегії
 (а)
(а)
| 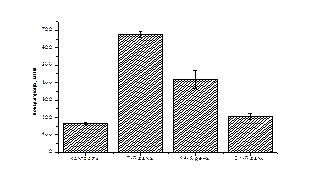 (б)
(б)
|
 (в) (в)
|  (г) (г)
|
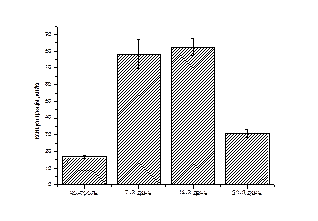 (д) (д)
|  (е) (е)
|
Рис. 3.2. Зміни концентрацій окремих коротколанцюгових жирних кислот (а –оцтова, б – пропіонова, в – масляна, г – ізовалеріанова, д – валеріанова, е - капронова) під впливом ніпазолу.
метаболізму призводить до того, що змінюється функціонування колоноцитів. З одного боку, останні перестають всмоктувати і утилізувати КЖК, в першу чергу пропіонову і масляну кислоти. З іншого боку, вони стають продуцентами токсичних форм кисню, таких, як супероксидіон, синглетний кисень, перекис водню, які призводять до збільшення активності та чисельності аеробної ланки мікрофлори. Ці процеси відбиваються в змінах окисно-відновного потенціалу як у приепітеліальній зоні, так і в просвіті кишечника. Відбувається "автономізація" епітеліальної підсистеми від мікроорганізмів - представників нормальної мікрофлори, порушення метаболітних взаємовідносин клітин епітелію з анаеробами, що, в свою чергу, впливає на руйнування взаємозв’язків усередині мікробоценозу [2, 3].
Динаміка зміни кількості капронової кислоти під впливом ніпазолу подібна до такої в оцтової кислоти. Її кількість зменшується на 7 і 14 день експерименту на 12,7 % і 21,6%, відповідно. Основними продуцентами капронової кислоти у кишечнику є бактерії родів Мegasphaera, Eubacterium, Peptococcus [4]. Результати дослідження кількості капронової кислоти за даних умов корелюють із отриманими нами даними чисельності бактерій родів Eubacterium, Peptococcus у складі мікробоценозу товстого кишечника щурів за перорального введення ніпазолу (див. табл. 3.2)
Отже, консервант ніпазол у досліджуваній концентрації впливає не тільки на якісний та кількісний склад представників мікрофлори кишечника досліджуваних тварин, а й на процеси метаболізму, що відбуваються за участю мікроорганізмів у даному біотопі. Таким чином, результати дослідження складу КЖК у вмістимому кишечника дослідних тварин, показали пряму кореляцію між кількістю досліджуваних метаболітів та чисельністю мікроорганізмів певних груп, що входять до складу нормальної мікрофлори кишечника тварин.