Повна енергiя молекули як сума трьох складових.
Енергія молекул складається з:
1. Енергій оптичних (валентних) електронів, які можуть знаходитися або на нижчих (незбуджених) енергетичних рівнях, або на одному із збуджених рівнів:
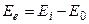 (2)
(2)
2. Енергії коливання атомів. Розрізняють декілька видів коливань:
а) Валентні - зумовлені періодичною зміною відстані між атомами по лінії, яка їх з'єднує. Якщо розглядати двоатомну молекулу як гармонічний осцилятор, можна розрахувати частоту таких коливань:
 , (3)
, (3)
де n - частота коливань,
F - силова константа,
m - приведена маса.
Енергія валентних коливань Ек = hn(v + 1/2), де v - коливальне квантове число. Енергія коливальних рівнів ніколи не дорівнює 0.
Для триатомних молекул можливі 2 види валентних коливань без зміни валентного кута

Рис. 1. Схема валентних коливань:
а – двоатомних молекул; б, в – триатомних молекул.
б) Для багатоатомних молекул можливі коливання із зміною валентних кутів - деформаційні. Деформаційні коливання бувають 4-х видів.

ножичкові маятникові крутильні віяльні
Рис.2. Схема деформаційних коливань
в) Як правило, зміна валентного кута супроводжується зміною міжатомних відстаней. Такі коливання називаються валентно-деформаційними.
3. Енергія обертання молекули як цілого навколо центра мас.
 (4)
(4)
де Iм - момент інерції молекули, який залежить від маси атомів і міжатомних відстаней,
j - обертальне квантове число.
Енергія молекули становить суму всіх видів енергій.
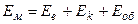 (5)
(5)
Найбільшу величину енергії мають електронні збуджені рівні. Коливальні рівні мають меншу енергію, обертальні - ще меншу:
Ee > Ek > Eоб
1000 : 100 : 1
Висновки: по-перше, молекула обертається навкруг своїх різних осей, знаходячись на певному рівні обертальної енергії, молекула може за рахунок поглинання перейти на більш високий рівень обертальної енергії. Це – обертальні переходи.
По-друге, атоми або групи атомів в молекулі коливаються одні відносно інших, і енергія цих коливань також квантується. Молекула може поглинути дискретну кількість енергії і перейти на рівень з більш високою коливальною енергією. Це – коливальні переходи.
По-третє, електрони молекули можуть переходити на більш високі рівні електронної енергії . Це – електронні переходи.
Відносні енергії переходів зменшуються в ряду: електронні > коливальні > обертальні, причому вони відрізняються приблизно на порядок. Для обертальних переходів достатньо низької енергії (великі довжини хвиль, мікрохвильова або дальня ІЧ-область). Коливальні переходи потребують більшої енергії (ближня ІЧ-область), а для здійснення електронних переходів необхідна ще більш висока енергія (видима і УФ-області).
Для кожного типу переходів існує багато різних можливих рівнів енергії, тому може поглинатися випромінювання з різними довжинами хвиль. Зазвичай переходи зображують з допомогою діаграми енергетичних рівнів (рис. 3).
|
|
|
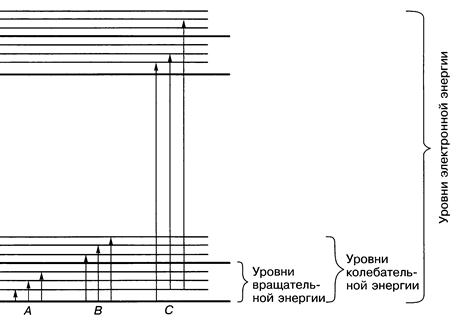
Рис.3. Діаграма енергетичних рівнів, яка ілюструє зміну енергії при поглинанні електромагнітного випромінювання: А – обертальні переходи, В – обертально-коливальні переходи, С – обертально-коливально-електронні переходи. Е0– основний електронний стан, Е1 – перший збуджений електронний стан.