Види спектрів
В аналітиці використовують спектри випромінювання і поглинання.Спектри бувають суцільні (безперервні), смугасті та лінійчасті. Суцільний спектр випромінювання складається з сукупності електромагнітних хвиль, довжини яких змінюються безперервно. Смугастий спектр складається з декількох смуг, в межах яких довжини хвиль змінюються безперервно, розділених інтервалами відсутності випромінювання. Лінійчасті спектри характеризуються сукупністю випромінювання певних довжин хвиль (рис. 6.).

Рис. 6. Види спектрів випромінювання: а - суцільний (безперервний), б - смугастий, в - лінійчастий.
Кожному можливому переходу між рівнями енергії відповідає певна спектральна лінія, яка характеризується в спектрі певною частотою або довжиною хвилі.
Спектр поглинання зображають у вигляді графічної залежності оптичної густини (поглинальної здатності) А або молярного коефіцієнта поглинання (ελ), чи пропускання (Т) від частоти (ν) або довжини хвилі (λ) (рис. 7). Інколи на осі ординат відкладають lg e, щоб мати змогу зобразити смуги з малою інтенсивністю поряд з високоінтенсивними. Частота при мінімумі пропускання (ν1, ν2) або довжина хвилі при максимумі поглинання (λ1, λ2) є параметрами для якісного аналізу, а залежність інтенсивності смуг поглинання або оптичної густини від концентрації використовують для кількісного аналізу. Переважно смуги мають правильну дзвоноподібну форму контуру, коли спектр є в координатах “А(e)-n”. Якщо в спектрі речовини є декілька смуг, то окремі з них часом можуть перекриватися, і тоді спектр поглинання ускладнюється.
Природа смуг поглинання в ультрафіолетовій (10-400 нм) і видимій (400-760 нм) областях спектра однакова і пов’язана з числом і положенням електронів в молекулах та йонах, а в інфрачервоній області (760-106 нм) – з коливанням атомів в молекулах.
У спектрі поглинання речовини може бути одна і більше смуг. Якщо в спектрі речовини є декілька смуг, то окремі з них часом можуть перекриватися і тоді спектр поглинання ускладнюється.
На відміну від лінійчастих спектрів поглинання атомів, спектр поглинання молекулмає смугастий характер, тобто складається з сукупності більш-менш розмитих смуг розділених ділянками практичної відсутності поглинання.
Причиною розмивання спектрів поглинання молекул є те, що електронні і коливальні рівні розщеплюються на коливальні та обертальні підрівні і поглинання супроводжується появою в спектрі великої кількості ліній з близькими довжинами хвиль, які, внаслідок обмеженості розділювальної здатності спектральних приладів, зливаються в смуги поглинання. Внаслідок різного співвідношення енергій електронних, коливальних і обертальних ліній смуги поглинання в УФ діапазоні більш розмиті, а в ІЧ діапазоні складаються з порівняно гострих піків.
|

Рис. 7. Залежність А і e від λ Рис. 8. Залежність Т від ν
6. Якісний аналіз за спектрами поглинання грунтується на таких їх властивостях:
1. Немає двох речовин, які б мали абсолютно однаковий спектр поглинання. Тому якісний аналіз (ідентифікацію) речовин проводять шляхом порівняння спектра досліджуваної речовини із спектрами відомих індивідуальних речовин, одержаних в однакових умовах.
2. Число смуг поглинання залежить від числа активних коливань в молекулі. Активними є коливання, які призводять до зміни дипольного момента молекули. Чим більше атомів в молекулі, тим більша кількість активних коливань.
3. Експериментально досліджено, що деякі функціональні групи в складі молекул мають характерні смуги поглинання великої інтенсивності, які мало залежать від загальної будови молекул. Такі смуги поглинання називають характеристичними або груповими.
Наприклад, якщо органічні молекули містять у своєму складі функціональні групи:

в спектрах поглинання будуть зафіксовані смуги поглинання при таких значеннях хвильових чисел: 3600-3800 ; 3000 та 1720-1780 см-1, відповідно. Аналогічно для неорганічних сполук - наявність груп =Si=O i –O–Si–O–Si–O– призводить до фіксації смуг поглинання з хвильовими числами 785-800 та 480-515 см-1 .
З допомогою характеристичних коливань можна проводити молекулярний, функціональний, а в деяких випадках, і фазовий аналіз.
Зміщення частоти характеристичних коливань дає інформацію про структуру молекули, про внутрішньомолекулярні або міжмолекулярні взаємодії. Таким чином, вивчення спектрів поглинання дає інформацію як про якісний склад, так і про структуру молекул.
Слід відмітити, що через велику кількість органічних і неорганічних речовин і порівняно малий набір функціональних груп, зробити однозначний висновок про якісний склад об'єкту аналізу тільки за даними спектра поглинання важко. Тому молекулярно-абсорбційний метод часто комбінують з іншими фізико-хімічними методами або з попереднім розділенням об'єкта аналізу на чисті компоненти або простіші суміші.
7. Основний закон світлопоглинання (Бугера-Ламберта-Бера)
Здатність поглинати (абсорбувати) передусім залежить від природи речовини та концентрації і може бути використана для її визначення. На цьому ґрунтуються фотометричні методи аналізу. З оптичних методів аналізу вони є найпоширенішими, тому що з їх допомогою можна визначати майже усі хімічні елементи.
Кількісна залежність поглинання світла від природи речовини і концентрації забарвленого розчину виражається законами світлопоглинання.
Основний закон світло поглинання встановлює залежність поглинальної здатності речовини від її природи, концентрації та товщини шару, через який проходить світло з початковою інтенсивністю (Іо).
Розглянемо кількісні закономірності поглинання монохроматичного випромінювання шаром речовини (рис.3.7.)

Рис. 9. Проходження променя світла через шар речовини.
При проходженні світла інтенсивністю Io через шар речовини, вміщеної в кювету з прозорого матеріалу, частина випромінювання (Ir) відбивається або розсіюється на поверхні розділу фаз, частина поглинається, витрачаючись на збудження молекул аналізованої речовини (Ia), решта (It) виходить з кювети:

Вибирають такі матеріали і геометрію кювети, щоб Ir < Ia. Для цього матеріал кювети має бути прозорим до падаючого світла, стінки кювети, через які світло заходить і виходить з кювети, повинні бути тонкими і плоскопаралельними. Тоді:
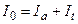
Бугер і Ламберт встановили, що однорідні шари однакової товщини (l) поглинають одну й ту ж частку падаючого світлового потоку. Математичним виразом такої залежності є експонента:
 ,
,
де l - товщина шару поглинаючої речовини,
k - коефіцієнт поглинання, який для індивідуальних речовин залежить від природи речовини, її концентрації, довжині хвилі падаючого світла і температури.
Бер встановив, що коефіцієнт поглинання пропорційний концентрації речовини.

Об'єднаний закон Бугера-Ламберта-Бера (Б-Л-Б) має вигляд:

Величину A = lgIo/It називають оптичною густиною або абсорбційністю. З використанням абсорбційності закон Б-Л-Б має вигляд:

де  - молярний коефіцієнт поглинання; l - товщина шару, що поглинає світло, см; С - концентрація розчину, моль/л.
- молярний коефіцієнт поглинання; l - товщина шару, що поглинає світло, см; С - концентрація розчину, моль/л.
Оптична густина є безрозмірною відносною величиною і може набувати значень від 0 до ¥. Однак апаратурні особливості, можливість прояву відхилень від основного закону світлопоглинання та інше зумовлюють використання в аналізі лише область значень А, що не перевищують одиниці.
Коефіцієнт e називають молярним коефіцієнтом поглинання або екстинкцією. Ця величина характеризує інтенсивність забарвлення речовини у розчині і індивідуальні властивості забарвлених сполук та є найважливішою їх оптичною характеристикою. e визначає чутливість фотометричної реакції і методу.
Чисельно він дорівнює абсорбційності зразка товщиною 1см при концентрації 1 моль/л, має розмірність л/моль ∙см. Екстинкція не залежить від товщини шару і концентрації поглинаючої речовини, а залежить від будови речовини, хвильового числа світла, що проходить через нього, температури і є фізико-хімічною константою речовини. Чисельні значення екстинкції, які використовуються в аналізі, в основному лежать в межах 10 –105. Так, для слабозабарвлених речовин (таких, як хромат калия) ελ = 400-500, для сильнозабарвлених, сполук кадмію або цинку з дитизоном, ελ досягає значень 85000 и 94000, відповідно. Значення ελ найбільш інтенсивно забарвлених сполук не перевищує, як правило, 100000-120000.
Якщо концентрацію розчину виразити в моль/л, то молярний коефіцієнт поглинання, який визначає межу виявлення речовини, характерну для даного методу, буде дорівнює тангенсу кута нахилу калібрувальної прямої до осі абсцис. Чим більший нахил калібрувального графіка до осі концентрацій, тим більш чутливим є даний фотометричний метод.
Частку поглинутого світла характеризує значення пропускної здатності (трансмісії):
 (Т£1).
(Т£1).
Коефіцієнтом пропускання прийнято вважати її відсотковий вираз:
Т,% = Т×100.
Пропускання зв’язане з оптичною густиною співвідношенням:
 .
.
Оптична густина розчину є адитивною величиною. Закон адитивності – важливе доповнення до закону Бугера-Ламберта-Бера. Сутністю закону адитивності є незалежність поглинання індивідуального речовини від наявності інших речовин, що володіють власним поглинанням, або індиферентних до електромагнітного випромінювання.
Якщо розчин містить декілька забарвлених речовин, що поглинають, то
А = А1 + А2 + … + Аn, або

де 1, 2, … n - окремі речовини.
Практика показує, що закон Бера не завжди виконується, тобто спостерігається нелінійна залежність коефіцієнта поглинання від концентрації. Одна з суттєвих причин відхилення має інструментальний характер і зумовлена немонохроматичністю світлового потоку. Численними є хімічні фактори, які спричиняють відхилення від основного закону. Ці фактори зумовлені участю поглинаючої речовини, наприклад, забарвленого комплексу, в конкуруючих реакціях – протолізу іона металу та ліганду, полімеризації центрального іона в комплексній сполуці, утворення комплексів іншого складу, таутомерних перетворень реагента. Щоб максимально уникнути впливу конкуруючих реакцій, проходження основного процесу оптимізують, тобто створюють умови максимального виходу аналітичної форми металу.
Причини відхилення від закону Бера можуть бути, зокрема, такі:
1. Немонохроматичність випромінювання.
2. Вплив сторонніх речовин (зміщення максимумів поглинання під дією молекул домішок або розчинника).
3. Перебіг у розчині реакцій дисоціації забарвлених речовин:

4. Гідроліз забарвлених речовиин, ступінь якого залежить від концентрації
[Cu(NH3)4]2+ + 2H2O  [Cu(NH3)3H2O]2+ + NH4OH
[Cu(NH3)3H2O]2+ + NH4OH
5. Недостатня стабільність забарвлених комплексів
FeSCN2+  Fe3+ + SCN–
Fe3+ + SCN–
червон. б/барвн.
Якщо немає надлишку іонів SCN–, рівновага може бути зсунена праворуч.
6. Вплив рН середовища. Під впливом йонів H+ можливий зсув рівноваги в бік утворення іншої сполуки:
2CrO42– + 2H+  Cr2O72– + H2O
Cr2O72– + H2O
Отже, закон Бугера-Ламберта-Бера має низку обмежень, які треба враховувати:
· закон справедливий лише для монохроматичного випромінювання;
· величина коефіцієнту ε залежить від показника заломлення середовища, який практично не залежить від концентрації тільки у випадку малих її значень. У разі високих концентрацій розчиненої речовини зміна показника заломлення спричиняє відхилення від закону;
· якщо в процесі зміни концентрації відбуваються фізико-хімічні зміни частинок, що поглинають світло (димеризація, полімеризація, міцелоутворення, зміна складу тощо), то це викликає відхилення від закону;
· температура під час вимірів повинна залишатися сталою;
· пучок випромінювання повинен бути паралельним.