Умови фотометрування.
Отриману в оптимальних умовах форму елемента фотометрують, тобто вимірюють оптичну густину розчину А. Розробка фотоколориметричної методики включає наступні етапи:
1. Вибір довжини хвилі світла. Якщо в розчині є один компонент, то для вимірювання вибирають довжину хвилі, що відповідає максимуму поглинання фотометрованої форми (λmax), бо це забезпечить найвищу чутливість визначення. Якщо таких смуг є декілька, то вибирають ту з них, яка є найінтенсивнішою. Це забезпечує найвищу чутливість визначення. Найліпше вибирати пологий максимум, тому що відхилення значень e тут незначні, якщо встановлення потрібної довжини хвилі відбувається з недостатньою точністю. Бажано, щоб довжина хвилі відповідала максимальному значенню екстинції даної забарвленої речовини.
2. Вибір світлофільтра. Кожен світлофільтр характеризується кривою пропускання, тобто залежністю Т,% – λ, та напівшириною смуги пропускання. Смуга пропускання коливається в межах кількох десятків нм для скляних і значно вужча (10–12 нм) для інтерференційних. З двох фільтрів ліпший той, для якого більший коефіцієнт Т і менша напівширина смуги пропускання. Щоб
правильно вибрати фільтр, треба знати спектр поглинання досліджуваного розчину. Бажано максимальне перекривання кривих поглинання та кривої пропускання фільтра чи наближення максимуму поглинання сполуки в розчині (λmax) до довжини хвилі максимального пропускання (Тmax) світлофільтра. Орієнтовно при виборі світлофільтра використовують відоме правило, що колір фільтра повинен доповнювати колір розчину. Якщо потрібно вибрати фільтр з двох (чи більше) наявних з близькими характеристиками, то обирають той, з яким оптична густина розчину найбільша. Робочими значеннями Ає межі 0,1–0,8, в яких середня відносна похибка визначення концентрації за рахунок похибки вимірювання Анайменша.
а) Максимум пропускання світлофільтра повинен відповідати максимуму поглинання речовини.
б) Якомога менша ширина пропускання світлофільтра, щоб випромінювання було близьке до монохроматичного.
3. Вибір розміру кювети. Довжина кювети повинна бути така, щоб абсорбційність лежала в межах 0,4 – 1, бо в цьому випадку досягається найменша похибка визначення концентрації. Хоч з основного закону значення А пропорційне ℓ за сталих ελ і С і здавалося б варто прагнути до максимальних значень ℓ, бо відносна похибка зменшується зі збільшенням ℓ, проте не варто виходити за межі А=1,0. За великих ℓ зростають втрати за рахунок розсіювання потоку розчином, тому ℓ>5,0 cм практично не використовують, враховуючи головне – зростання похибки визначення С при А>1,0.
4. Вибір розчину порівняння. Вимірювання Арозчину завжди проводять стосовно розчину порівняння, при виборі якого враховують відповідність його складу досліджуваному розчину. Найліпшим варіантом є той, коли розчином порівняння є розчин холостого досліду. Часто за розчин порівняння беруть воду чи інший прозорий у цих умовах розчинник, вводячи поправку на поглинання сторонніми компонентами. Для більшої точності абсорбційність розчину порівняння повинна бути близькою до абсорбційності досліджуваного розчину. Неправильний вибір розчину порівняння може призвести до систематичної похибки фотометричного визначення.
5. Спосіб приготування стандартних розчинів має бути ідентичним до способу приготування досліджуваних розчинів.
12. Способи визначення концентрації.
Залежно від вимог, які поставлено до аналізу, природи об’єкта аналізу та інших факторів вибирають один з таких способів знаходження концентрації визначуваного компонента: калібрувального графіка, порівняння оптичних густин, стандартних добавок та молярного коефіцієнта.
Розрахунок концентрацій при вимірюванні абсорбційності на одній довжині хвилі або при використанні одного світлофільтру може проводитися наступними методами:
1. При однаковій довжині кювети за методом калібрувального коефіцієнта Cx = kAx, де k = Сст/Aст. Метод вимагає виконання закона Бера. За способом градуйованого графіка готують серію (5-6) стандартних розчинів за вибраних оптимальних умов. Бажано, щоб у межах серії зберігався основний закон світлопоглинання, а оптичні густини серій вкладалися в оптимальні межі з найкращою відтворюваністю результатів (0,1–1,0). Фотометрують серію розчинів при вибраних значеннях λ чи λмакс світлофільтра та ℓ і будують залежність А – С, яка повинна бути прямою, що проходить через початок координат. Спосіб градуйованого графіка застосовують у випадку серійних аналізів однотипних проб, у разі виконання важливих завдань – арбітражу, атестації стандартних зразків і т.п.
2. Спосіб порівняння ґрунтується на порівнянні оптичних густин досліджуваного (Ах) і стандартного (Аст) розчинів. Реакцію утворення забарвленої сполуки в обох розчинах проводять в аналогічних умовах. Цей спосіб застосовують при поодиноких визначеннях і він вимагає обов’язкового збереження основного закону, тому концентрацію стандартного розчину вибирають якомога ближчою до концентрації досліджуваного.
3. Якщо умови приготування стандартних і досліджуваних розчинів важко відтворити, користуються різновидом способу порівняння – способом добавок. Він ґрунтується на порівнянні оптичних густин досліджуваного розчину (Ах, Сх) і того ж розчину, але з відомою добавкою (Са) визначуваного компонента (Ах+а).
4. Ще одним різновидом способу порівняння є спосіб молярного коефіцієнта, за яким концентрацію Сх розраховують з рівняння основного закону. Величину ε знаходять у довідниках. Якщо в довідниках немає відповідних даних, ε визначають експериментально за допомогою стандартного розчину: ε = Aст/Cст lст.
5. У практиці фотометричного аналізу виникає потреба визначати окремі компоненти в дво- і полі компонентних забарвлених системах. В основу аналізу таких систем покладено правило адитивності оптичних густин. При наявності в розчині декількох речовин з різними спектрами поглинання, але які частково перекриваються, можливе визначення концентрацій окремих речовин, якщо виміряти абсорбційності на різних довжинах хвиль або світлофільтрах. Внаслідок адитивності абсорбційності на одній довжині хвилі, для цього випадку можна написати:
A(l1) = e1(l1)C1l + e2(l1)C2l
A(l2) = e1(l2)C1l + e2(l2)C2l
Якщо відомі абсорбційності двох речовин на двох довжинах хвиль, ці рівняння складають систему двох рівнянь з двома невідомими, яке можна розв'язати відносно С1 і С2. Якщо абсорбційності не відомі, їх можна визначити, вимірявши абсорбційності двох стандартних розчинів цих речовин на двох довжинах хвиль в однакових умовах.
Кількість вимірювань на різних довжинах хвиль повинна бути більшою або рівною кількості визначуваних речовин.
6. Незважаючи на всі переваги, фотометричний метод має один недолік – невисока точність визначення, яку можна оцінити в 2–5% відносних. Для підвищення точності методу та розширення інтервалу визначуваних концентрацій застосовують різницевий варіант (“диференційна фотометрія” – невдалий термін) фотометрії. Його відмінною рисою є те, що замість розчинника, холостого розчину чи іншого розчину порівняння застосовують
забарвлений розчин визначуваного компонента відомої концентрації. Вимірюють відносну величину оптичної густини Авідн чи відносного пропускання Твідн=T0/Тх. Отож, аналітичним сигналом є 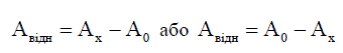
де А0 – оптична густина розчину порівняння, який може мати меншу чи більшу оптичну густину від оптичної густини досліджуваного розчину.
Звичайний фотометричний метод можна вважати окремим випадком різницевого варіанта, в якому А0=0 і тоді Авідн=Ах. Звичайний варіант називають ще абсолютною фотометрією.
При використанні фотометрії з візуальною детекцією порівняння інтенсивності забарвлення досліджуваного і стандартного розчинів може здійснюватися такими способами:
1. Метод стандартних серій. Готують серію стандартних розчинів з певним кроком за концентрацією речовини, яку визначають. Наливають їх в кювети з однаковою довжиною поглинаючого шару. Досліджуваний розчин наливають в таку ж кювету і вибирають дві кювети з стандартними розчинами, інтенсивність кольору в яких більше і менше інтенсивності кольору досліджуваного розчину. Концентрація речовини в досліджуваному розчині знаходиться в межах концентрацій цих стандартних розчинів.
Метод практично не вимагає обладнання, але досить трудомісткий, точність його не перевищує 10 %. Не вимагається виконання закону Б-Л-Б.
2. Метод розбавлення. В дві кювети з однаковою довжиною поглинаючого шару наливають досліджуваний і стандартний розчини так, щоб інтенсивність забарвлення стандартного розчину була меншою ніж досліджуваного. Проводять розбавлення досліджуваного розчину об'ємом V0 до вирівнювання забарвлення і вимірюють кінцевий об'єм досліджуваного розчину – Vx. Концентрацію речовини розраховують за формулою:
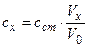
Метод точніший, ніж попередній і не вимагається виконання закону Б-Л-Б.
3. Метод зміни довжини поглинаючого шару. В дві кювети наливають досліджуваний і стандартний розчини так, щоб інтенсивність забарвлення стандартного розчину була меншою, ніж досліджуваного. Занурюючи скляний стержень в кювету з досліджуваним розчином, зменшуюь довжину поглинаючого шару lx до вирівнювання його забарвлення із забарвленням стандартного розчину з довжиною шару lст . Концентрацію розраховують за формулою:
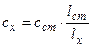
Метод вимагає виконання закону Б-Л-Б.