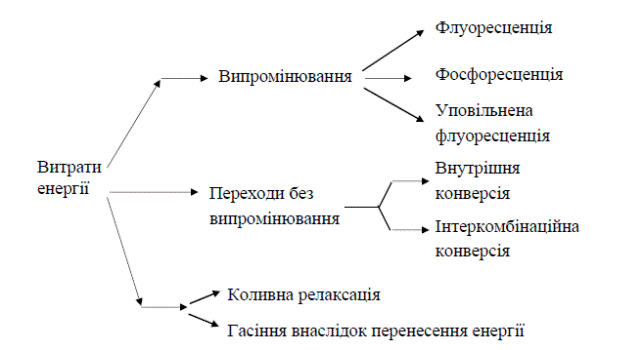
Механізм люмінесценції
Розглянемо детальніше механізм збудження молекулярної люмінесценції та її видів.
Отриману енергію молекула може втрачати різними шляхами, серед яких може бути і випромінювання відповідно до схеми:
Молекула, поглинаючи квант світла, переходить із основного стану S0 у збуджений електронний стан, наприклад S1 (рис. 2).
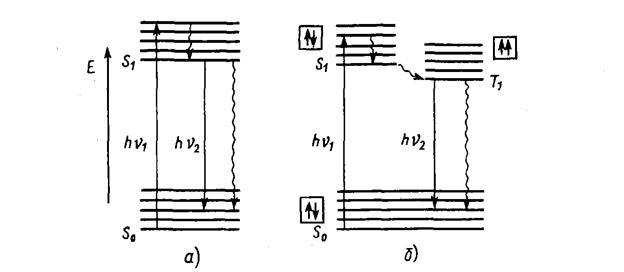
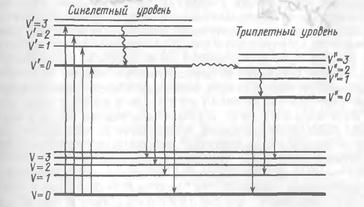
Рис. 2. Схема енергетичних переходів молекули, яка ілюструє виникнення флуоресценції (а) і фосфоресценції (б) (схема Яблонського)
При кімнатній темпертурі молекула зазвичай знаходиться в основному коливальному стані. Переходячи у збуджений стан, молекула попадає на один з його коливальних рівнів.
Поглинання молекулою кванту енергії здійснюється за дуже короткий час (10-15 с), далі за ~ 10-12 с відбувається перехід електрона на нижній коливальний рівень збудженого стану (рис. 2, а, коротка хвиляста стрілка). Цей процес називається коливальною релаксацією. Повернення молекули з нижнього коливального стану S1 в незбуджений стан S0 може відбутися 3 шляхами:
1) втрата молекулою енергії у вигляді тепла в результаті зіткнень з іншими частинками, (процес внутрішньої конверсії, зображений на рис. 2, а, довга хвиляста стрілка); вказані процеси втрати енергії (внутрішня конверсія і коливальна релаксація)протікають дуже швидко (~ 10-12 с), через що флуоресценція з більш високих станів, ніж S1, зустрічається рідко.
2) повернення молекули на будь-який коливальний підрівень основного стану з випусканням енергії у вигляді кванта світла без зміни спіна електрона (флуоресценція).Для молекул більшості органічних сполук при кімнатній температурі це поглинання відповідає переходу з нижнього коливального рівня основного стану на один із коливальних рівнів першого або другого збудженого електронного стану тієї ж мультиплетності (S1, S2).
3) перехід молекули із збудженого стану S1 в метастабільний стан Т1, а далі в основний S або в результаті внутрішньої конверсії з виділенням теплоти (рис. 2, б, довга хвиляста стрілка), або з виділенням кванта світла (фосфоресценція).
Явище фосфоресценції можна пояснити, згадавши про синглетний і триплетний стан молекул (мультиплетність – число, яке характеризує спіновий стан багатоелектронної системи). Відомо, що основний стан молекули – синглетний, в якому всі спіни електронів спарені (S0). Найстійкішим станом більшості молекул є синглетний, тобто стан з сумарним спіном, рівним 0. В синглетному стані електрони, які займають одну і ту ж молекулярну орбіталь, антипаралельні:↑↓. Електронні переходи без зміни спіна називаються синглет-синглетними, наприклад, S0 → S1, S0 → S2, S1 → S0. Із них перші два переходи відбуваються при поглинанні світла, останній – при флуоресценції. Триплетний рівень молекули (Т) характеризується двома неспареними електронами, тому він має меншу енергію порівняно з відповідним синглетним. В триплетному стані (Т1, Т2 і ін.) спіни збудженого електрона і того, що залишився в основному стані, паралельні: ↑↑. Сумарний спін дорівнює 1.
Поки молекула знаходиться у збудженому стані, у одного з електронів може змінитися спін, і молекула перейде в більш низький за енергією триплетний стан за допомогою інтеркомбінаційної конверсії. Завдяки процесам внутрішньої конверсії і коливальної релаксації молекула далі досягає нижнього коливального рівня першого збудженого триплетного стану (Т1). Звідси молекула може повернутися в основний стан S0 через випускання фотона. Це випускання і називають фосфоресценцією.
Переходи між синглетним і триплетним станами, наприклад, S1→ Т1 (рис. 2, б) в принципі заборонені (за правилами відбору, згідно яких заборонені переходи із зміною спіна електрона). Час життя електрона в збудженому синглетному стані складає10-8-10-5 с, а в триплетному – не менше 10-4 с. Таким чином, імовірність переходу між двома синглетними станами набагато вища, ніж між синглетним і триплетним. Прямий перехід з основного стану S0 в триплетний в результаті поглинання фотона (тривалість цього процесу порядку10-15 с) практично неможливий. Молекула може опинитися в триплетному стані тільки в результаті переходів електронів із збуджних синглетних станів.
Але такі переходи, які називаються, ще раз, інтеркомбінаційною конверсією, можуть здійснюватися в деяких умовах, наприклад, у присутності важких атомів (наприклад, галогенів). Час життя триплетного стану досить великий (10-3 – 10-2 с).
Молекули в триплетному стані легко втрачають свою енергію у процесах без випромінювання – дезактивуються з виділенням тепла. Дезактивація може відбутися при взаємодії молекули в триплетному стані з молекулами, які мають неспарені електрони (наприклад, з молекулами Оксигену), а також при зіткненнях з іншими частинками. Тому флуоресценція спостерігається набагато частіше за фосфоресценцію, особливо у рідких розчинах, де фосфоресценція зазвичай не спостерігається.
Фосфоресценція – процес триваліший, ніж флуоресценція. Тривалість процесу фосфоресценції становить від 10-3 до 10 с. Особливо тривалий світіння спостерігається в разі біолюмінесценції. Для того, щоб виміряти фосфоресценцію, зразки заморожують, охолоджуючи їх до температури рідкого азоту (-196ºС), при цьому процес зіткнення зводяться до мінімуму. Інтенсивна фосфоренсценція спостерігається у органічних сполук в у скловидному стані, коли мінімальна дифузія. Тверді зразки, наприклад, неорганічні мінерали, також демонструють тривалу фосфоресценцію.