Пояснення причин розмивання хроматографічних піків.
Метою хроматографічного процесу є розділення суміші речовин. Єдиної стрункої теорії, яка кількісно описує весь процес хроматографічного розділення, до теперішнього часу немає. Встановлення теоретичної залежності між хімічною будовою речовин і його коефіцієнтом розподілу між фазами, знання якої дозволяє передбачити хроматографічну поведінка речовини, є завданням, яке ще чекає свого вирішення. Тому в даний час запропонований ряд теоретичних підходів, що використовують деякі допущення і дозволяють досить задовільно описувати хід хроматографічного процесу.
Теорії хроматографії розглядають поведінку речовини і розподіл її концентрації всередині хроматографічної колонки. Завданням теорій хроматографічного розділення є встановлення законів руху компонентів аналізованої суміші в хроматографічній колонці і визначення факторів, які впливають на його ефективність. На основі допущень теорій хроматографічного аналізу прогнозують оптимальні умов розділення компонентів газової або рідкої суміші.
На практиці завжди є потреба оцінки одержаних хроматограм. При проходженні через колонку можна отримати хроматограми різного виду (рис. 6). Всі теорії хроматографічного розділення зводяться до розгляду цих величин: селективності і ефективності.
Проходження зони речовини через колонку завжди супроводжується її розмиванням. У підсумку погіршується розділення компонентів суміші. Таким чином, з точки зору кінцевого результату, тобто визначення компонентів проби, розмивання є небажаним процесом і повинно зводиться до мінімуму.
Для пояснення поведінки розчиненої речовини під час її елюювання існує дві теорії: теорія еквівалентних тарілок та дифузійна теорія. Згідно них пояснити розмивання хроматографічних піків можна з позицій лінійності або нелінійності ізотерми адсорбції та швидкості дифузії молекул у нерухомій і рухомій фазах.
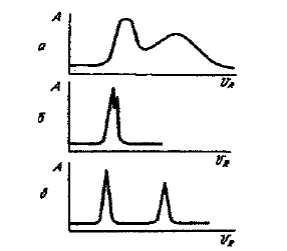
Рис. 6. Вплив селективності та ефективності на роздільну здатність: а – висока селективність, низька ефективність, б – низька селективність, висока ефективність, в – висока селективність, висока ефективність.
Отже, існуючі теорії розглядають процес хроматографії базуючись на:
1) характері ізотерми сорбції речовини, що хроматографується;
2) швидкості встановлення стану міжфазної рівноваги.
Залежно від типу ізотерми адсорбції розрізняють лінійну та нелінійну хроматографію. За малих концентрацій речовин, які адсорбуються, усі типи ізотерм адсорбції мають вигляд близький до лінійного. Тому здебільшого процес переміщення речовини вздовж шару сорбенту при елююванні може бути описаний саме з позицій лінійної хроматографії. При цьому вважають, що рівновага розподілу речовини між адсорбентом і рухомою фазою встановлюється миттєво; у таких випадках йдеться про так звану ідеальну хроматографію. Варіант лінійно-ідеальної хроматографії, коли взаємодії сорбент-сорбат описуються лінійною ізотермою, а рівновага встановлюється миттєво, є найбільш простим для теоретичного опису варіантом хроматографії.
Однак на практиці адсорбційна рівновага встановлюється не миттєво, а упродовж певного інтервалу часу, що призводить до розмиванняхроматографічної смуги (кривої елюювання). Це характерно для так званої неідеальної хроматографії. Тому у практиці аналізу найпоширенішою є лінійна неідеальна хроматографія, коли розподіл між нерухомою та рухомою фазами описується лінійною ізотермою адсорбції, а рівновага сорбції встановлюється не миттєва, а впродовж певного періоду часу.
За отриманою під час хроматографічного аналізу хроматограмою суміші (рис. 1) можна розрахувати експериментальні значення важливих хроматографічних параметрів, зокрема, фактору утримування (ємності) (k), коефіцієнту селективності (α), критерія розділення (RS) та оцінити ефективність хроматографічної колонки. Розрахунки проводять на основі теорій хроматографічного розділення.
Розглянемо спочатку найпростіший випадок математичного опису кількісних характеристик лінійної ідеальної хроматографії і виведемо деякі важливі співвідношення між хроматографічними параметрами.
Основне завданнятеорії ідеальної хроматографії – встановити залежність між швидкістю пересування компонента вздовж шару сорбента і його здатністю до сорбції.
Тут переміщення речовини уздовж хроматографічної колонки під час її промивання рухомою фазою описується рівнянням

де Uc – лінійна швидкість переміщення речовини вздовж шару сорбенту (см/хв); ω – об'ємна швидкість потоку рухомої фази (мл/хв); V0 і Vа – об'єми відповідно рухомої (вільний об'єм колонки) та нерухомої фаз із розрахунку на одиницю довжини колонки; C і Cа - відповідно концентрація та вміст речовини в рухомій і нерухомій фазах.
У випадку лінійної ізотерми адсорбції dСа/dC=Cа/C=Γ, тому рівняння набуває такого вигляду:
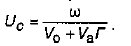
У випадку рідкої нерухомої фази замість коефіцієнта Генрі (Г) використовують коефіцієнт розподілу (D).
З наведеного рівняння випливає, що швидкість переміщення речовини в хроматографічній колонці зростає зі збільшенням швидкості потоку рухомої фази і є тим меншою, чим більша величина коефіцієнта Генрі, тобто чим краще адсорбується речовина на даному адсорбенті.
Для характеристики переміщення речовин у хроматографічній колонці лінійна швидкість руху Uc є незручною величиною, оскільки вона залежить від швидкості потоку рухомої фази. Відносна швидкість переміщення адсорбованої речовини в колонці дорівнюватиме

U0 – швидкість переміщення рухомої фази.
Утримуваний об'єм адсорбату (Vr) обернено пропорційний швидкості його переміщення у хроматографічній колонці, і утримуваний об'єм рухомої фази V0 також обернено пропорційний швидкості її переміщення в тій самій колонці. Тому отримуємо:

З урахуванням того, що Vr' =Vr – V0, рівняння перетворюється на вираз
V'r= Va ∙ Г,
з якого випливає, що виправлений утримуваний об'єм дорівнює добутку коефіцієнта Генрі (коефіцієнта розподілу) на величину об'єму нерухомої фази. Це основні рівняння хроматографії.
З рівняння також випливає, що відношення виправлених утримуваних об'ємів двох речовин дорівнює відношенню їхніх коефіцієнтів Генрі (розподілу), тобто селективності α.