Молекулярна рефракція.
На заряджені частинки, які здійснюють вимушені коливання в результаті впливу світлової хвилі, впливають сусідні заряджені частинки – електрони і ядра інших атомів і молекул. Чим більше цих частинок в одиниці об'єму, тим помітніше позначається цей вплив. Це положення в найзагальнішому вигляді пояснює залежність показника заломлення від густини речовини. Ця залежність може бути виражена таким чином:
f(n)=r∙d
де r – коефіцієнт пропорційності, який називається питомою рефракцією.
Таким чином, не сам показник заломлення, але деяка функція від нього знаходиться в прямопропорційній залежності від густини речовини.
Для вираження функції f(n) і , відповідно, для розрахунку рефракції, було запропоновано декілька рівнянь. Найбільшого поширення набула теоретично обґрунтована формула Лоренца-Лорентца.
На підставі уявлень про поляризацію атомів і молекул речовини (діелектрика) в електричному полі можна прийти до висновків, що функція f(n) має вигляд:
f(n)=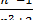
тоді
 = r∙d
= r∙d
звідки
r=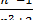 ∙
∙
Це вираз для питомої рефракції носить назву формули Лоренца-Лорентца(розмірність питомої рефракції відповідає питомому об'єму, м3/кг). Питомий об'єм – об'єм одиниці маси речовини, величина обернена густині.
Якщо розглянути деякий коефіцієнт α, значення якого характеризує величину диполя, виникаючого в молекулі під впливом електричного поля, напруженість якого дорівнює одиниці (1 в/м), то виявляється, що для даної речовини з молекулярною масою М значення питомої рефракції прямопропорційне α:

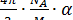
де NA – число Авогадро.
Величина α залежить від природи речовини і називається поляризованістю. Поляризованість є характеристикою деформації молекул під дією електричного поля.
Множення питомої рефракції на молекулярну масу дає величину молекулярної рефракції Rв м3/кмоль:
R= r∙M=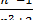 ∙
∙ ∙α
∙α
Після підстановки чисельних значень π і NA маємо:
R=2,52∙1024∙α
Таким чином, величина молекулярної рефракції визначається лише інтенсивністю поляризації молекул речовини і, залежить від її поляризованості α, яка визначається тільки природою речовини і не залежить від зовнішніх умов, температури, тиску, а значить, і від агрегатного стану речовини.
Тому молекулярну рефракцію за Л.-Л. можна розглядати як середню міру поляризованості молекул. Питома рефракція  це рефракція, яка відповідає одному кілограму речовини.
це рефракція, яка відповідає одному кілограму речовини.
У зв'язку з тим що поляризація молекули є сумарний ефект поляризації атомів, що входять до її складу, чисельне значення молекулярної рефракції повинно бути сумою атомних рефракцій. Тому молекулярна рефракція є адитивною властивістю (від лат. Additivus – одержуваний шляхом складання).
Адитивність молекулярної рефракції була використана для визначення величин рефракцій атомів і атомних груп (радикалів). Рефракція групи СН2 може бути знайдена по різниці молекулярнихних рефракцій будь-яких двох сусідніх членів гомологічного ряду насичених вуглеводнів:
RС7Н16 – RС6Н14 = RСН2
Встановивши рефракцію групи СН2, можна визначити атомну рефракцію кисню за наступною різницею:
Rо = (RС2Н5СООН – 3RСН2)
(RС2Н5СООН – 3RСН2)
Це, в свою чергу, дозволить розрахувати атомну рефракцію водню:
RН = (RС2Н5ОН – Rо – RСН2)
(RС2Н5ОН – Rо – RСН2)
Атомна рефракція вуглецю, природно, дорівнює:
RС = RСН2 – 2 RН
RСН2 – 2 RН
Таким чином, визначивши експериментально, шляхом вимірювання показника заломлення і густини, молекулярні рефракції відомих сполук можна застосувати отримані дані для розрахунку атомних рефракцій.
При роботі з сполуками, що мають подвійний і потрійний зв'язок між вуглецевими атомами, слід враховувати так звані інкременти зв'язків. Інкремент – приріст, значення, на яке збільшується дана величина. В данному випадку йде мова про збільшення величини молекулярної рефракції речовини з подвійним і потрійним зв’язком у порівнянні з сумою атомних рефракцій.
Так, наприклад, для бензолу маємо:
RС6Н6 = 6RС + 6RН +3 RС=С
6RС + 6RН +3 RС=С
Це виявляється необхідним і при роботі з деякими іншими класами сполук. Поряд з атомними рефракції і інкрементами зв'язків при розрахунку молекулярних рефракцій використовуються рефракції атомних груп – радикалів (RNO2, RNO3, RSO3 та ін.).
Якщо перехід речовини в розчин не супроводжується зміною поляризованості його молекул або молекул розчинника, то молекулярна рефракція розчину, як наслідок адитивності цієї величини, повинна складатися з рефракцій компонентів з урахуванням кількості їх молекул (кіломолей) в системі:
Rр-ну = Rр-ка ∙Nр-ка + Rр. р-ни ∙Nр. р-ни
де Nр-ка і Nр. р-ни – кіломольні частки розчинника і розчиненої речовини.
Це однаковою мірою справедливо як для розчинів рідких, так і для розчинів твердих речовин.
Визначення величини молекулярної рефракції є одним з методів, які застосовуються при визначенні складу речовини і структури його молекул, при ідентифікації речовини.
Дослідження, що проводяться при з'ясуванні будови речовини, у багатьох випадках також зводяться до його ідентифікації, наприклад, при встановленні тієї з вірогідних ізомерних структур, яка відповідає отриманому індивідуальному речовині. Тут прибігають до визначення величини молекулярної рефракції, значення якої прямо пов'язане зі складом і будовою сполуки.
Для експериментального визначення молекулярної рефракції необхідно виміряти показник заломлення речовини і його густини (при одній і тій же температурі). Значення молекулярної рефракції обчислюється потім за формулою. Отримане значення порівнюється з величиною, знайденою як сума атомних рефракцій (за табличними даними) відповідно до передбачуваної формулою речовини. Досить задовільний збіг знайдених в тому і іншому випадку значень може служити підтвердженням правильності уявлень про склад і будову досліджуваної речовини, складених на підставі даних хімічного аналізу і вивчення хімічних і фізико-хімічних властивостей.
Вибір між можливими варіантами будови речовини може бути, природно, зроблений тільки в тому випадку, якщо різниця рефракцій для них виразно перевищує допустимі значення помилок. Вимірювання, здійснювані з метою ідентифікації речовини, повинні проводитися при температурі, відповідної табличним значенням коефіцієнтів заломлення.