Фазовые диаграммы
Если система состоит из двух компонентов (К=2) и между ними не происходит химического взаимодействия, то при наличии жидкой и паровой фаз число фаз Ф=2. Согласно правилу фаз, число степеней свободы такой системы составляет: С = К + 2 – Ф = 2 + 2 – 2 = 2
Следовательно, из трёх независимых параметров, полностью определяющих состояние системы, - температуры, давления и концентрации одной из фаз – можно произвольно выбрать любые два; при этом определится значение третьего параметра, которое уже не может быть произвольным. Однако при анализе и расчёте процессов перегонки жидкостей одну из переменных обычно закрепляют и строят так называемые фазовые диаграммы в плоской системе координат. При этом возможны следующие варианты фазовых диаграмм: Р – t (x=const); P – x (t=const); t – x (P=const). Вид этих зависимостей определяется взаимной растворимостью компонентов жидкой смеси и другими их свойствами. Смеси с неограниченной взаимной растворимостью компонентов делятся на идеальные и реальные. Идеальными называются растворы, подчиняющиеся закону Рауля. При смешивании компонентов идеального раствора тепловой эффект отсутствует и объём смеси практически не изменяется.
Для технических расчётов наиболее важной является диаграмма t – x,y, т.к. обычно процессы перегонки в промышленных аппаратах протекают при P=const, т.е. в изобарных условиях. На этой диаграмме по оси абсцисс отложены концентрации жидкой х и паровой у фаз, отвечающие разным температурам.

| Рис. 29. Зависимость температур кипения и конденсации от состава фаз (диаграмма t – x,y) |
Для построения зависимости температур кипения и конденсации соответственно от состава жидкости или пара, т, е. диаграммы t – x,y, (рис. 29), откладывают на оси ординат при постоянном внешнем давлении, температуры кипения t1, t2, t3, соответствующие составам жидких смесей х1, х2, х3, отложенным на оси абсцисс. Через полученные точки и точки, отвечающие температурам кипения чистых компонентов tA и tB, откладываемых на крайних ординатах диаграммы, проводят линию кипения АА1А2А3В.
Затем на оси абсцисс откладывают определенные по закону Рауля равновесные составы паров у1*, у2*, у3* и проводят из соответствующих им точек прямые до пересечения с изотермами, отвечающими температурам t1, t2, t3. Соединив точки пересечения В1, В2, В3 . . ., с точками А и В плавной кривой, получают линию конденсации А В1В2В3В.
При пользовании диаграммой на оси абсцисс откладывают состав жидкой смеси и проводят из соответствующей точки вертикаль до пересечения с линией кипения. Далее из точки пересечения проводят горизонталь вправо до пересечения с линией конденсации. Абсцисса точки пересечения указывает состав равновесного пара.
На фазовой диаграмме у—х (рис. 30) наносится линия равновесия выражающая в данном случае зависимость между равновесными составами (по низкокипящему компоненту) жидкой (хА) и паровой (уА*) фаз. Процессы перегонки осуществляют обычно при постоянном внешнем давлении. Поэтому диаграмма строится при Р = соnst, т. е. для переменных температур кипения, изменяющихся в зависимости от изменения состава жидкой смеси.
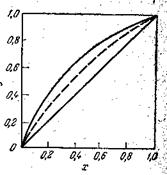
| Рис. 30. Диаграмма равновесия пар – жидкость (диаграмм у – х). |