Фазовое равновесие, линия равновесия
Рассмотрим процесс массопередачи, в котором аммиак, представляющий собой распределяемый компонент, поглощается из его смеси с воздухом чистой водой.
Обозначим: Фх – жидкая фаза; Фу – газовая фаза; х0 – начальная концентрация аммиака в жидкой фазе; у0 – начальная концентрация аммиака в газовой фазе.
Очевидно, что х0 = 0, у0 ≠ 0.
При соприкосновении газа с жидкостью начинается переход аммиака из газовой в жидкую фазу (абсорбция). Скорость этого процесса зависит от концентрации аммиака в воде и на границе раздела фаз: wa = Ka·y (Ka- константа скорости абсорбции).
Скорость обратного процесса – десорбции аммиака – зависит от концентрации аммиака в воде: wд = Kд·х (Kд- константа скорости десорбции).
С течением времени скорость абсорбции будет снижаться, а скорость десорбции – возрастать. В определённый момент скорость абсорбции становится равной скорости десорбции. При этом не будет происходить видимого перехода вещества из фазы в фазу, т.е. установится динамическое равновесие.
В условиях равновесия некоторому значению действующей концентрации аммиака в жидкой фазе х соответствует строго определённая равновесная концентрация в газовой фазе у*. Соответственно, концентрации у соответствует равновесная концентрация х*. В общем виде связь между концентрациями распределяемого вещества в фазах при равновесии выражается:
у* = f(х) или х* = f(y’).
Любая из этих зависимостей изображается графически линией равновесия, которая либо является кривой, как показано на рис. , либо в частном случае— прямой линией. На рис. , а показана равновесная кривая для системы с компонентами - носителями, выражающая зависимость равновесной концентрации, например в газовой фазе, от концентрации жидкой фазы при Р = соnst и t = const. На рис. -1, б приведен пример равновесной кривой для процесса ректификации, построенной при Р = const. Каждая точка кривой, как показано на рисунке, соответствует разным температурам.
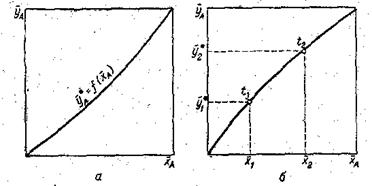
Рис. Диаграммы равновесия: а – при р = const и t = const; б – при p = const.
Отношение концентраций фаз при равновесии называется коэффициентом распределения: m = y*/x
Для разбавленных растворов линия равновесия близка к прямой, и m является практически величиной постоянной, равной тангенсу угла наклона линии равновесия.
Конкретный вид законов равновесного распределения, выражающих зависимости ( ) и ( ), различен для разных, процессов массопередачи. Так, например, в процессе абсорбции при низких концентрациях распределяемого вещества в исходном растворе равновесие описывается законом Генри, для идеальных растворов в процессах ректификации — законом Рауля и т. д.
Как будет показано ниже, зная линию равновесия для конкретного процесса и рабочие, т. е. неравновесные, концентрации фаз в соответствующих точках, можно определить направление и движущую силу массопередачи в любой точке аппарата. На основе этих данных может быть рассчитана средняя движущая сила, а по ней — скорость процесса массопередачи.