рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Химическая технология, часть 1
Реферат Курсовая Конспект
Химическая технология, часть 1
Химическая технология, часть 1 - раздел Философия, Федеральное Агентство По Образованию ...
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химическая технология, часть 1
Учебное пособие
для студентов химического факультета
УФА
РИЦ БашГУ
| |
Учебное пособие предназначено для студентов химического 3-го курса химического факультета Башгосуниверситета. Оно включает 3 раздела, посвящённых
Составитель:
Доц,., к.х.н. Базунова М.В.
Лекция №1
Тема: «Введение»
План лекции:
1) Предмет химической технологии;
2) Связь химической технологии с теоретической химией, физикой, техникой, экономикой;
3) Химическая промышленность как предпосылка развития науки «Химическая технология»;
4) Краткие сведения по истории развития химической технологии;
5) Основные разделы, предлагаемые к изучению в курсе «ОХТ, ч. 1»;
6) Классификация процессов химтехнологии;
7) Виды и ресурсы сырья;
8) Основные направления рационального использования химического сырья;
Предмет химической технологии
Слово «технология» произошло от латинских слов «techne» - мастерство, ремесло и «logos» - понятие, учение, следовательно, дословно слово «технология» можно перевести как «наука о ремёслах». Под технологией в шароком значении этого слова понимают научное описание методов и средств производства в какой-либо отрасли промышленности. Например, методы и средства обработки металлов составляют предмет технологии металлов.
Химическая технология – это наука о наиболее экономичных и экологически обоснованных методах переработки сырых природных метериалов в предметы потребления и средства производства.
Связь химической технологии с теоретической химией, физикой, техникой, экономикой
Химическая промышленность как предпосылка развития науки «Химическая… Развитие химической технологии как науки неотделимо от её практического приложения, т. е. химической промышленности.…Краткие сведения по истории развития химической технологии
Во второй половине 18 века началось выделение технологии в специальную отрасль знания, закладывались основы химической технологии как науки. Впервые… Химическая технология в конце 18 века стала обязательной учебной дисциплиной в… Основные вехиКлассификация процессов химтехнологии
Объектами исследованийхимической технологии являются значительное многообразие процессов, что часто затрудняет разработку их единой классификации. Наиболее распространена классификация процессов, основанная на различии в основных законах, описывающих скорость их протекания. В соответствии с этой классификацией различают:
1) Гидромеханические процессы, скорость которых определяется законами гидравлики (примеры: осаждение твёрдых частиц в жидкости, перемешивание жидкостей, транспортировка жидкостей и газов).
2) Тепловые процессы, скорость которых определяется законами теплопередачи (примеры: испарение, конденсация).
3) Массообменные (диффузионные) процессы, скорость которых определяется законами массопередачи (примеры: перегонка, абсорбция, экстракция и т.д.).
4) Механические процессы: измельчение твёрдых материалов, классификация по размерам, смешение твёрдых сыпучих материалов.
5) Химические процессы, скорость которых определяется закономерностями химической кинетики.
Закономерности, описывающие первые четыре вида процессов, опираются, в основном, на законы физики и изучены достаточно хорошо. Менее изучены и представляют больший интерес для студентов-химиков химические процессы.
Запишем также определения установившихся и неустановившихся процессов. При неизменных во времени характеристиках процесса в каждой точке технологического аппарата говорят о стационарном (установившемся) процессе; при этом упомянутые характеристики могут изменяться от одной точки аппарата к другой.
При изменяющихся во времени характеристиках в аппарате в целом или в каких-либо его точках говорят о нестационарном (неустановившемся) процессе.
Виды и ресурсы сырья
В химическом производстве на различных стадиях переработки можно выделить следующие материальные объекты: исходные вещества или собственно сырье,…Ресурсы и рациональное использование сырья
В себестоимости продукции химической промышленности доля сырья достигает 70% . Поэтому проблема ресурсов и рационального использования сырья при его переработке и добыче весьма актуальна.
Основные направления рационального использования сырья:
1) применение более дешёвого сырья (местного, с минимальными затратами на добычу);
2) использование менее концентрированного сырья (бедных руд);
3) комплексная переработка сырья, т.е. метод, при котором в максимальной степени извлекаются и используются все ценные компоненты, содержащиеся в сырье. Примером комплексной переработки руд является переработка апатитовой руды:
Лекция №2
Тема: «Гидравлика. Гидростатика»
1) Общие сведения по гидравлике;
2) Гидростатика. Понятие давления;
3) Дифференциальные уравнения равновесия Эйлера.
Общие сведения по гидравлике
Многие технологические процессы химической промышленности связаны с движением жидкостей, газов или паров, перемешиванием в жидких средах, а также разделением неоднородных смесей путём отстаивания, фильтрования и центрифугирования. Скорость этих процессов описывается законами гидромеханики, которые изучают в гидравлике.Гидравлика-это наука, изучающая законы равновесия и движения различных жидкостей.Гидравлику подразделяют на гидростатику (законы равновесия жидкостей в состоянии покоя) и гидродинамику (законы движения жидкостей). При этом принятообъединять жидкости, газы и пары под единым названием – жидкости, поскольку при скоростях потоков, значительно меньших, чем скорость звука, законы движения жидкостей без существенных поправок справедливы для газов и паров. Поэтому в дальнейшем под жидкостями будем понимать все вещества, обладающие текучестью.
В гидравлике при выводе основных законов используют понятие так называемой идеальной жидкости, под которой (в отличие от реальной) подразумевают жидкость, абсолютно несжимаемую, не изменяющую своей плотности под действием температуры и давления и не обладающую вязкостью.
Реальные жидкости подразделяются на капельные и упругие (газы и пары). Капельные жидкости можно считать практически несжимаемыми, они обладают относительно малым коэффициентом объёмного расширения.
Гидростатика. Понятие давления
Представим себе сосуд с жидкостью. Выберем внутри покоящейся жидкости произвольно площадку площадью ∆S, к которой приложена сила ∆F в… ∆F/∆S – среднее гидростатическое давление столба жидкости, а… р=lim(∆F/∆S)Дифференциальные уравнения равновесия Эйлера
Выделим внутри покоящейся жидкости элементарный параллепипед объёмом dV = dxdydz, рёбра которого ориентированы параллельно осям координат. Сила… Давление р является функцией трёх переменных: р = f(x.y.z)Основное уравнение гидростатики
После интегрирования уравнений (1) и (2) выясняется, что значение давления вдоль оси х и вдоль оси у не изменяется , остаётся постоянным. Т.к. –ρg – δр/δz = 0, - δр/δz = ρg - давление вдоль оси z изменяется, это изменение давления можно вычислить, зная плотность…Z + р/γ = const (5) – основное уравнение гидростатики.
Это уравнение говорит нам о том, что жидкость, находящаяся в равновесии и в покое обладает какими-то видами энергии, т.е. основное уравнение гидростатики – это частный случай закона сохранения энергии.
Выразим энергию в произвольных точках 1 и 2 внутри покоящейся однородной капельной жидкости относительно произвольно выбранной плоскости отсчёта. Плоскость отсчёта перпендикулярна плоскости рисунка, ОО – линия пересечения плоскости отсчёта с плоскостью рисунка.
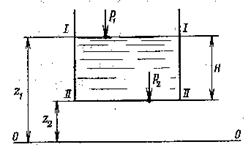
| Рис. 3. |
z1 и z2 - высоты расположения двух точек внутри покоящейся жидкости, называются нивелирным или геометрическим напором. Геометрический напор выражает удельную потенциальную энергию положения данной точки 1 или 2 над произвольно выбранной плоскостью сравнения ОО.
p1 и р2 – пьезометрическое давление столба жидкости, находящейся выше точки 1 и 2 соответственно.
p1/γ и р2/γ - пьезометрические напоры.
z1 + р1/γ = z2 + р2/γ (6) -для каждой точки покоящейся жидкости сумма нивелирной высоты и пьезометрического напора столба жидкости есть величина постоянная. Или, другими словами, сумма удельной потенциальной энергии положения и удельной потенциальной энергии давления для любой точки покоящейся жидкости есть величина постоянная и равная полному гидростатическому напору.
Закон Паскаля
Для вывода закона Паскаля рассмотрим две точки в покоящейся жидкости, одна из которых расположена внутри объёма жидкости (точка 1) на высоте z от произвольно выбранной плоскости сравнения, а другая находится на поверхности жидкости – на высоте z0 от той же плоскости. Пусть р и р0 – давления в точках 1 и 2 соответственно. Согласно основному уравнению гидростатики: z + р/γ = z0 + р0/γ.
р/γ = z0 + р0/γ.- z (умножим обе части на γ),
Р = р0 + γ(z0 – z) – математическое выражение закона Паскаля
Определение: давление в любой точке покоящейся несжимаемой жидкости передается одинаково всем точкам её объёма.
Покажем данное утверждение наглядно:
При постоянной температуре относительный удельный вес жидкости γ = ρg есть величина постоянная; разность ( z0 – z) (разность нивелирных напоров) тоже величина постоянная, следовательно γ(z0 – z)=const – обозначим данное произведение буквой А, тогда: р = А + р0
Пусть р0 = 1 атм, то р = А + 1 атм
Увеличим р0 на 4 атм: р = А + 5 атм
∆р0 = 4 атм; ∆р = 4 атм - то есть, насколько изменилось давление в точке на поверхности жидкости, настолько оно изменилось и в любой точке в объёме жидкости.
Следствием закона Паскаля является принцип сообщающихся сосудов: если давление над сообщающимися сосудами одинаковое, то жидкость в сосудах находится на одном уровне:
р1 = р2 → z1 = z2
Этот принцип используют для измерения уровня и объёма жидкости в закрытых аппаратах с помощью водомерных стёкол.
Гидростатические машины
Наиболее распространённым типом гидростатических машин является гидравлический пресс, который применяют для прессования и брикетирования различных… При приложении сравнительно небольшого усилия к поршню 1, движущемся в… Таким образом, поршень 2 передаст силу давления, во столько раз превышающую силу, приложенную к поршню 1, во сколько…Приборы для измерения давления
При р1>р2 (т.е. давление в аппарате выше атмосферного) и равновесии… р’ = р1 + ρgz1; р’ = р2 + ρgz2.Лекция №3
Тема: Гидродинамика. Основные характеристики потока.
Цель:Дать определения основных характеристик движения жидкости, вывести соотношения между силами, действующими на движущуюся жидкость.
План
1. Движущая сила перемещения жидкости;
2. Внутренняя и внешняя задача гидродинамики;
3. Основные характеристики движения жидкости;
4. Дифференциальные уравнения движения Эйлера;
5. Уравнение Бернулли для идеальных жидкостей.
6. Уравнение Бернулли для реальных жидкостей.
7.
Движущая сила перемещения жидкости
Перемещение жидкости по трубопроводам, каналам, аппаратам происходит вследствие перепада давления ∆р, создаваемого разностью уровней жидкости или работой специальных машин – насосов.
Внутренняя и внешняя задача гидродинамики
Различают внутреннюю и внешнюю задачи гидродинамики. Внутренняя задача связана с анализом движения жидкости внутри труб и каналов. Внешней задачей гидродинамики является изучение закономерностей обтекания жидкостями различных тел.
Основные характеристики движения жидкости
Количество жидкости, протекающее через всё поперечное сечение трубопровода или аппарата в единицу времени, называется расходом жидкости. Различают объёмный расход W (измеряется в м3/с, м3/ч) и массовый расход M… Количество жидкости, протекающее через единицу поперечного сечения трубопровода в единицу времени называется скоростью…Дифференциальные уравнения движения Эйлера
Движение жидкости является установившимся или стационарным, если скорость частиц потока, а также все другие влияющие на его движение факторы… Выделим внутри потока элементарный параллепипед объёмом dV = dxdydz, рёбра… Запишем принцип динамики: сумма проекций на оси координат всех сил, действующих на движущийся элементарный объём,…Уравнение Бернулли для идеальных жидкостей
Сначала разделим обе части уравнений системы на ρ, получим: -(δр/δх)·dx = d( wx2/2),Z + p/ρg+ w2/2g = const - уравнение Бернулли
z – нивелирный напор
p/ρg – пьезометрический напор
z + p/ρg - полный гидростатический напор
w2/2g – динамический (скоростной напор), выражает удельную кинетическую энергию движения жидкости.
z + p/ρg+ w2/2g – полный гидродинамический напор, обозначим Н.
Для двух произвольных сечений жидкости можно записать:
z1 + p1/ρg+ w 12/2g = z2 + p2/ρg+ w 22/2g ,
то есть для любого сечения или точки потока при установившемся движении идеальной жидкости сумма потенциальной (z + p/ρg) и кинетической (w2/2g) энергий жидкости остаётся величиной постоянной.Таким образом, уравнение Бернулли выражает частный случай закона сохранения энергии.
Уравнение Бернулли для реальных жидкостей
z1 + p1/ρg+ w 12/2g > z2 + p2/ρg+ w 22/2g. При этом часть потенциальной энергии переходит в потерянный напор hп.… z1 + p1/ρg+ w 12/2g = z2 + p2/ρg+ w 22/2g + hп.Лекция №4
Тема: Гидродинамика. Основные характеристики потока.
Цель:Продолжить изучение закономерностей движения жидкости.
План
1. Дифференциальное уравнение неразрывности потока.
2. Режимы движения жидкости.
3. Распределение скоростей по сечению потока.
4. Определение расхода газа и жидкости приборами с переменным перепадом давления.
5. Определение расхода газа и жидкости приборами с переменным перепадом давления.
Дифференциальное уравнение неразрывности потока
Режимы движения жидкости
Распределение скоростей по сечению потока
Скорость любого самопроизвольного процесса можно выразить как отношение движущей силы процесса к сопротивлению движения. Движение слоя жидкости… Оценим скорость движения слоя жидкости, непосредственно прилегающего к стенке…Определение расхода жидкости и газа потока с помощью гидродинамических трубок
Если поместить трубку 1 в движущуюся жидкость или газ, то ее открытый конец, направленный навстречу потоку, будет воспринимать полное давление…Определение расхода газа и жидкости приборами
С переменным перепадом давления
Принцип действия приборов с переменным перепадом давления основан на том, что на пути движения жидкости или газа ставят преграду с отверстием. … В качестве преград применяют диафрагмы, сопла и трубки Вен- тури (рис. 51),…Определение расхода газа или жидкости
Приборами с постоянным перепадом
Действие этих приборов основано на уравновешивании силы тяжести поплавка… Этот принцип использован в ротаметре (рис ), который представляет собой вертикально установленную коническую…Лекция №5
Тема: Гидромеханические процессы.
Цель:Изучитьгидромеханические процессы на примере способов разделения неоднородных (гетерогенных) систем.
План
1. Определение неоднородных систем.
2. Виды гидромеханических процессов.
3. Осаждение частиц под действием силы тяжести:
а) Скорость осаждения;
б) Закон Стокса
4. Центрифугирование.
5. Фильтрация:
а) Под атмосферным давлением;
б) Под избыточным давлением;
в) Под вакуумом.
6. Псевдоожижение.
Определение неоднородных систем
Таблица. Классификация неоднородных систем. Название неоднородной системы Дисперсионная …Виды гидромеханических процессов
Процессы, протекающие в гетерогенных системах и подчиняющиеся законам гидравлики, называют гидромеханическими. К таким процессам относятся:
Осаждение
Центрифугирование
Фильтрование
Псевдоожижение
Осаждение частиц под действием силы тяжести
Осаждение – процесс разделения жидких или газовых гетерогенных систем путём выделения из жидкой или газовой фазы твёрдых или жидких частиц дисперсной фазы.
Процесс осаждения может происходить под действием различных сил. В соответствии с этим к осаждению относят следующие процессы:
- отстаивание,то есть осаждение под действием силы земного тяготения;
- центрифугирование,то есть осаждение под действием центробежной силы;
- электроосаждение,то есть осаждение под действием сил электрического поля.
Скорость осаждения. Закон Стокса
G = mg. Если отсутствует сопротивление среды, то скорость осаждения частицы w равна w… В реальных условиях при движении частицы в жидкой фазе возникает сопротивление среды R, которое пропорционально…Центрифугирование
Для создания поля центробежных сил обычно используют один из двух способов: либо обеспечивают вращательное движение потока в неподвижном аппарате,… Для оценки эффективности осаждения под действием центробежной силы сравним его… Центробежная сила, действующая на частицу, составляетФильтрация
- это процесс разделения суспензий, пылей или туманов путём пропускания их через пористую перегородку (фильтр), способную задерживать взвешенные в… Движущей силой процесса фильтрования является разность давлений до и после… ∆р = робщ – р2,Фильтрация под атмосферным давлением
Предполагается, что р1 = р2 = 1 атм, р1 - р2 = 0, тогда скорость фильтрации будет
wф = рпм/γводы = hпм – высота столба жидкости,
рпм/γводы = hпм – высота столба жидкости,
следовательно, wф =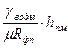 . Все величины в дробной части формулы – постоянные, обозначим эту дробь
. Все величины в дробной части формулы – постоянные, обозначим эту дробь  через А, значит скорость фильтрации при атмосферном давлении зависит только от высоты столба жидкости над фильтровальной перегородкой. Это уравнение
через А, значит скорость фильтрации при атмосферном давлении зависит только от высоты столба жидкости над фильтровальной перегородкой. Это уравнение
wф =А·hпм описывает прямую линию, исходящую из начала координат, с тангенсом угла наклона к оси абсцисс, равным 
Фильтрация под избыточным давлением
Если при фильтровании суспензию на фильтровальную перегородку подают под давлением (например, с помощью насоса), то говорят о фильтрации под избыточным давлением. Таким образом в данном случае р2 = 1 атм, движущая сила процесса ∆р =р1 – р2
Скорость фильтрации wф =
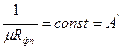 ,
,
w = A’∆р + B – уравнение прямой линии, В – отсечение на оси ординат, показывающее, какой будет скорость при атмосферном давлении.
Фильтрация под вакуумом
Если пространство под фильтровальной перегородкой присоединить к источнику вакуума, то уменьшиться р2. Такой процесс называется фильтрацией под вакуумом.
Движущая сила процесса ∆р =р1 – р2 , р1 = 1атм, р2 – остаточное давление, ∆р – величина вакуума. Уравнение для скорости фильтрации такое же, как и в случае фильтрации под избыточным давлением.
В технологии для интенсификации процесса фильтрации часто используют фильтрацию под избыточным давлением или под вакуумом. Наиболее распространённые типы промышленных фильтров: нутч-фильтры (работают под вакуумом или под избыточным давлением), фильтр-прессы (работают под давлением), ленточные вакуум-фильтры.
Псевдоожижение
Режим псевдоожижения («кипящего слоя») достигается при таком состоянии системы «твёрдое тело – газ2, когда вес зернистого материала, приходящийся на… Состояние «кипящего слоя» обеспечивается при таком значении скорости W… Процессы в «кипящем слое» характеризуются развитой поверхностью в системах «твёрдое тело – газ», низким сопротивлением…Лекция №5
Тема: Тепловые процессы.
Цель:Изучитьосновные понятия, определения и закономерности тепловых процессов.
План
1. Основы теплопередачи.
2. Виды распространения тепла.
3. Тепловые балансы.
4. Основное уравнение теплопередачи.
5. Перенос тепла через плоскую стенку.
Основы теплопередачи
Движущей силой тепловых процессов является разность температур более нагретого и менее нагретого тела. Тела, обменивающиеся теплом, называются… Теплообменом называется самопроизвольная передача тепла от более нагретого… Теплопередачей называется перенос теплоты от более нагретой среды к менее нагретой через разделяющую их стенку.Виды распространения тепла
Теплопроводность – это перенос тепла вследствие беспорядочного теплового движения микрочастиц, непосредственно соприкасающихся друг с другом. Для… Тепловое излучение – это процесс распространения энергии с помощью… Конвекция – это перенос тепла за счёт макроскопических объёмов жидкости или газа. Если массовое перемещение жидкости…Тепловые балансы
Q = Q1 = Q2, или Q = G1(H1н – Н1к) = G2(H2к – Н2н), где Q1 – количество теплоты, отдаваемое горячим теплоносителем; Q2 – количество теплоты,… Выражение для теплового баланса говорит: тепловая нагрузка по всей цепочке… Если необходимо учесть потери тепла в окружающую среду, то полученное по уравнениям ( ) значение Q следует повысить на…Основное уравнение теплопередачи
Для непрерывного процесса теплопередачи Q = KF∆tср. Поскольку расчёт тепловых потоков, как правило, проводят по уравнениям теплового баланса, то основное уравнение…Различные способы переноса тепла
, (4) где dQ – количество тепла, передаваемое посредством теплопроводности; dF… Производная температуры по нормали к изотермической поверхности называется температурным градиентом (изменение…Теплоотдача
При ламинарном движении теплоносителя и равномерном распределении скорости и температуры на начальном участке трубы у поверхности стенки образуются… Теплоотдача при естественной конвекции.Этот вид теплоотдачи возникает при…Теплопередача
Теплопередача при постоянных температурах теплоносителей. Рассмотрим перенос теплоты при установившемся процессе через многослойную плоскую стенку… Рис. 5. Схема к выводу уравнения теплопередачи через плоскую …Лекция №6
Тема: Аппаратура для теплообмена.
Цель:Познакомитьс применяемой в промышленности аппаратурой для теплообмена, научить проводить подбор нагревающих и охлаждающих агентов, основываясь на знании их областей применения, преимуществ и недостатков.
План
- Источники тепла и методы нагревания. Нагревающие агенты.
- Охлаждающие агенты
- Теплообменные аппараты.
Источники тепла и методы нагревания. Нагревающие агенты
Тепловая энергия для проведения технологических процессов может быть получена различными способами и от разных источников. Прямыми источниками тепла являются: 1) Дымовые газы;Охлаждающие агенты
Для охлаждения до 10-30 0С используют доступные и дешёвые охлаждающие агенты – воду и воздух. По сравнению с воздухом вода отличается большой теплоёмкостью, более высоким коэффициентом теплоотдачи (αводы = 100-400, αвозд. = 10-30) и позволяет проводить охлаждение до более низких температур.
До -20 0С можно охлаждать с помощью крепких растворов солей, т.н. рассолов (растворов хлорида кальция, магния и др.). Они являются промежуточными теплоносителями между испарителем холодильной машины и охлаждаемой средой.
Для охлаждения до – 40 0С и ниже используют сжиженные газы (СО2, этан, N2). Эти хладагенты циркулируют в специальных холодильных установках, где теплота от охлаждаемой среды отнимается при их испарении.
Теплообменные аппараты
Для осуществления длительной работоспособности в процессе эксплуатации при обработке среды, загрязненной или выделяющей отложения на стенках… В химических производствах до 70% теплообменных аппаратов применяют для сред… Режим работы теплообменного аппарата и скорость движения теплоносителей необходимо выбирать таким образом, чтобы…Классификация теплообменников
Теплообменникаминазываются аппараты, предназначенные для передачи тепла от одних веществ к другим.
Аппараты с рубашкой. Двойные стенки или рубашки широко используются для обогрева реакционных аппаратов, особенно в тех случаях, когда внутри аппарата нельзя установить змеевики (например, в аппарате со скребковой мешалкой и др.). Схема устройства паровой рубашки показана на рис. 9.
| Рис. 9.Схема устройства паровой рубашки. 1 – корпус аппарата; 2 - рубашки; 3-5 – штуцеры. | 
|
По способу передачи тепла различают теплообменники смешения и поверхностные.
В поверхностных теплообменниках перенос тепла между обменивающимися теплом средами происходит через разделяющую их поверхность теплообмена – глухую стенку.
В теплообменниках смешения тепло передаётся от одной среды к другой при их непосредственном соприкосновении.
Поверхностные теплообменники очень распространены и их конструкции весьма разнообразны. Довольно просты в устройстве поверхностные змеевиковые теплообменники, которые бывают двух типов: погружного и оросительного. Основным теплообменным элементом является змеевик-труба, согнутая по определенному профилю.
На рис. 13-8, а, б показаны погружные теплообменники с одним (а) и несколькими (б) спиральными змеевиками 1, по которым движется теплоноситель. Змеевики погружаются в жидкость (теплоноситель II), находящуюся в корпусе аппарата. Скорость движения жидкости мала вследствие большого сечения корпуса аппарата, что обусловливает низкие значения коэффициентов теплоотдачи наружной стенки змеевика к жидкости (или наоборот). Для увеличения этого коэффициента теплоотдачи повышают скорость движения жидкости путем установки в корпусе аппарата 2, внутри змеевика, стакана (на рис. 13-8 не показан). В этом случае жидкость движется по кольцевому пространству между стенками аппарата и стакана с повышенной скоростью. Вследствие простоты устройства, низкой стоимости, доступности наружных стенок змеевика для чистки и осмотра, возможности работы змеевиков при высоких давлениях эти теплообменники находят достаточно широкое применение в промышленности. Погружные змеевиковые теплообменники имеют сравнительной большую поверхность теплообмена (до 10-15 м2).

Рис. 13-8. Аппараты с погружными теплообменниками:
а - с одним спиральным змеевиком; б - с несколькими спиральными змеевиками; в -с прямыми трубами; 1 - погружные трубы; 2 - корпуса; I и II – теплоносители.
Оросительные теплообменники примеряют в основном для охлаждения жидкостей и газов или конденсации паров. Оросительный теплообменник представляет собой змеевик (рис. 13-10) из размещенных друг над другом прямых труб 1, соединенных между собой калачами 2. Снаружи трубы орошают водой, которую подают в желоб 3 для равномерного распределения охлаждающей воды по всей длине верхней трубы змеевика. Отработанная вода поступает в корыто 4 для сбора воды. По трубам протекает охлаждаемый теплоноситель. Орошающая теплообменник вода при перетекании по наружным стенкам труб частично испаряется: при этом процесс теплообмена идет интенсивнее, вследствие чего расход воды на охлаждение в оросительных теплообменниках ниже, чем в холодильниках других типов. Но при этом происходит необратимая потеря воды. Во избежание сильного увлажнения воздуха в помещении оросительные теплообменники обычно устанавливают на открытом воздухе. По этой же причине, если оросительный теплообменник необходимо установить в помещении, его приходится помещать в громоздкие кожухи, которые подключают к системе вытяжной вентиляции. К недостаткам этих теплообменников следует отнести также громоздкость, неравномерность смачивания наружной поверхности труб, нижние ряды которых могут вообще не смачиваться и практически не участвовать в теплообмене. Поэтому, несмотря на простоту изготовления, легкость чистки наружных стенок труб и другие достоинства, оросительные теплообменники находят ограниченное применение.

Рис. 13-10. Оросительный холодильник:
1 - трубы; 2 - соединительные колена (калачи); 3 - желоб для распределения охлаждающей воды; 4 - корыто для сбора воды.
Двухтрубные теплообменники часто называют теплообменниками типа «труба в трубе». Они представляют собой набор последователъно соединенных элементов, состоящих из двух концентрически расположенных труб (рис. 13-7). Один теплоноситель I движется по внутренним трубам 1, другой II - по кольцевому зазору между внутренними и наружными 2 трубами. Внутренние трубы 1 соединяются с помощью калачей 3, а наружные - с помощью соединительных патрубков 4. Поскольку сечения внутренней трубы и кольцевого зазора невелики, то в этих теплообменниках достигаются значительные скорости движения теплоносителей (до 3 м/с), что приводит к увеличению коэффициентов теплопередачи и тепловых нагрузок, замедлению отложения накипи и загрязнений на стенках труб. Однако двухтрубные теплообменники более громоздки, чем кожухотрубчатые, на их изготовление требуется больше металла на единицу поверхности теплообмена. Двухтрубные теплообменники применяют для процессов со сравнительно небольшими тепловыми нагрузками и соответственно малыми поверхностями теплообмена (не более десятков квадратных метров).
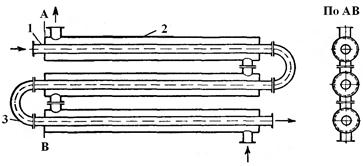
| Рис. 11. Теплообменники типа «труба в трубе»: 1 – внутренняя труба; 2 - внешняя труба; 3 – колено. |
Кожухотрубчатые теплообменники. Они достаточно просты в изготовлении, отличаются возможностью развивать большую поверхность теплообмена в одном аппарате, надежны в работе. Простейшей конструкцией аппаратов такого типа являются кожухотрубчатый теплообменник (рис. 12). В кожухе 1 размещен трубный пучок, теплообменные трубы 2 которого развальцованы в трубных решетках 3. Трубная решетка жестко соединена с кожухом. С торцов кожух аппарата закрыт распределительными камерами 4 и 5. Кожух и камеры соединены фланцами.

|
| Рис. 12. Теплообменник с неподвижной трубной решеткой. |
Для подвода и отвода рабочих сред (теплоносителей) аппарат снабжен штуцерами. Один из теплоносителей в этих аппаратах движется по трубам, другой - в межтрубном пространстве, ограниченном кожухом и наружной поверхностью труб. В связи с этим исключена возможность взаимных перемещений труб и кожуха. Аппараты этого типа называют еще теплообменниками жесткой конструкции.
Если температурные напряжения, возникающие в стенках теплообменника или трубках, оказываются большими, то необходимо предусматривать температурную компенсацию. Упругая деформация при удлинении трубок может восприниматься приваренными к кожуху линзовыми компенсаторами (рис. 13). В этом аппарате температурные деформации компенсируются осевым сжатием или расширением компенсатора. Применение кожухотрубчатых теплообменников с температурным компенсатором на кожухе (линзовый компенсатор) ограничено предельно допустимым давлением в кожухе, равным 1,6 МПа. При большем давлении в кожухе (1.6-8,0 МПа) следует применять теплообменники с плавающей головкой или с U-образными трубами.
| Рис. 13. Теплообменник с компенсаторами температурных удлинений. 1 – компенсатор; 2 – теплообменник. | 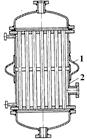
|
При большей разности температур может произойти изгиб и деформация труб, поэтому для компенсации температурных удлинений и свободного удлинения труб одну из трубных решеток не закрепляют наглухо или соединяют ее с кожухом при помощи сальникового уплотнения, с тем, что решетка могла свободно перемещаться. Аппараты, в которых одна из трубных решеток не прикреплена к кожуху и имеет свободное осевое перемещение, называют теплообменниками с «плавающей» головкой (рис. 14).
| Рис. 14. Теплообменник с «плавающей» головкой. 1 – кожух; 2 - плавающая головка. | 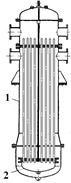
|
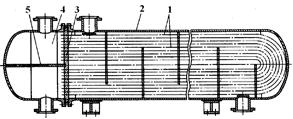
В некоторых конструкциях устанавливаются трубки U-образной формы, оба конца которых развальцованы в одной трубной решетке (рис. 15). Компенсация температурных удлинений трубок в данном случае достигается тем, что каждая трубка может свободно удлиняться независимо от других.
|
| Рис. 15. Теплообменник с U-образными трубками. 1 - U-образные трубки; 2 – кожух; 3 – трубная решетка; 4 – распределительная камера; 5 – перегородка. |
Лекция №7
Тема: Массообменные процессы.
Цель:Датьопределение массообменных процессов, их движущей силы, массопередачи, массоотдачи, кратко охарактеризовать виды массообменных процессов, познакомить с правилом фаз.
План
- Основные понятия и определения.
- Виды массообменных процессов (абсорбция, адсорбция, перегонка, экстракция, ионный обмен, сушка, растворение, кристаллизация, мембранные процессы.
- Способы выражения составов фаз.
- Правило фаз Гиббса.
- Фазовое равновесие, линия равновесия.
Основные понятия и определения
Массообменными называются процессы, скорость которых определяется скоростью переноса вещества из одной фазы в другую в направлении достижения равновесия.
Движущей силой процесса массообмена является градиент концентраций распределяемого между фазами вещества: ∆с = с – ср, где с – фактическая концентрация вещества в данной фазе; ср – равновесная концентрация.
Как и в любых других процессах, движущая сила массообмена характеризует степень отклонения системы от состояния динамического равновесия.
Процесс перехода вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия называют массопередачей. Массопередача осуществляется, как правило, при непосредственном соприкосновении фаз (за исключением мембранных процессов). При этом граница соприкосновения – т. е. поверхность контакта фаз – может быть подвижной (система газ – жидкость, жидкость – жидкость) или неподвижной (газ – твёрдое, жидкость – твёрдое).
Перенос вещества внутри фазы – из фазы к границе раздела фаз или наоборот – от границы раздела в фазу – называют массоотдачей.
Массообменные процессы широко используются в промышленности для решения задач разделения жидких и газовых гомогенных смесей, их концентрирования, а также для очистки сточных вод и отходящих газов производственных процессов.
Виды массообменных процессов
Абсорбция– избирательное поглощение газов или паров из газовых или паровых смесей жидкими поглотителями (абсорбентами). Этот процесс представляет… раб = Раб(1-x), где Раб – давление паров чистого абсорбента; раб – давление… Процесс, обратный абсорбции, называется десорбцией. Избирательная абсорбция в сочетании с десорбцией используется для…Способы выражения составов фаз
Принято для выражения состава смесей пользоваться различной системой концентраций и наиболее распространёнными являются массовые, молярные и… а) массовые концентрации (обозначим хi) Рассмотрим систему, состоящую из n компонентов. Обозначим массы 1-го, 2-го и n-го компонентов через g1, g2,……gn…Правило фаз Гиббса
Система, достигнув состояния равновесия, может далее существовать как угодно долго без каких-либо видимых качественных и количественных изменений.… Условием, необходимым для обеспечения равновесия системы, является постоянство… Если по тем или иным причинам равновесие нарушится, система будет вновь стремиться прийти к равновесному состоянию.…Фазовое равновесие, линия равновесия
Обозначим: Фх – жидкая фаза; Фу – газовая фаза; х0 – начальная концентрация аммиака в жидкой фазе; у0 – начальная концентрация аммиака в газовой… Очевидно, что х0 = 0, у0 ≠ 0. При соприкосновении газа с жидкостью начинается переход аммиака из газовой в жидкую фазу (абсорбция). Скорость этого…Лекция №8
Тема: Массообменные процессы (продолжение). Перегонка жидкостей.
Цель:Представить в общем виде составление материального баланса любого массообменного процесса, вывести уравнения рабочей линии для верхней и нижней части любого массообменного процесса, дать определение движущей силы массообменных процессов и познакомить с графическим способом определения направления переноса вещества из фазы в фазу.Дать общие сведения о перегонке жидкостей.
План
- Материальный баланс. Рабочая линия.
2. Движущая сила массопередачи и направление переноса вещества из фазы в фазу
3. Перегонка жидкостей. Общие сведения.
Материальный баланс. Рабочая линия
Рассмотрим схему массообменного аппарата, работающего в режиме идеального вытеснения при противотоке фаз (рис. Х-2). Пусть в процессе массопередачи… Тогда материальный баланс по всему веществу Gн + Lн = Gк + Lк и материальный баланс по распределяемому компонентуДвижущая сила массопередачи
И направление переноса вещества из фазы в фазу
Со стороны газовой фазы: движущей силой процесса является разность между действующей концентрацией данного компонента в газовой фазе и концентрацией… Распределяемое вещество всегда переходит из фазы, где его содержание выше…Перегонка жидкостей. Общие сведения
В химической технологии, нефтехимической и других отраслях промышленности используют широкое разнообразие жидких и газовых смесей, подлежащих разделению на достаточно чистые компоненты или фракции различного состава. Часто разделение таких смесей при контакте жидкой и паровой фаз, сопровождающееся перераспределением компонентов между фазами, достигается перегонкой.
Перегонка – это процесс, включающий испарение разделяемой смеси и последующую конденсацию образующихся паров. Этот процесс можно осуществить однократно или многократно. В результате конденсации получают жидкость, состав которой отличается от состава исходной смеси.
В основе перегонки лежит различная летучесть составляющих смесь компонентов, т.е. разная склонность их к переходу из жидкой фазы в паровую или в обратном направлении. Пусть, например, в колбе находиться жидкая смесь метанола и воды с концентрацией метанола 40 %. Если эту смесь нагреть до кипения и подвести некоторое дополнительное количество теплоты, то образовавшаяся (в небольшом количестве) паровая фаза, находящаяся в контакте с оставшейся жидкой смесью, будет содержать ≈73 % метанола, т.е. обогатится метанолом.
Пусть теперь от парообразной смеси бензола и толуола, содержащей 40 % бензола и находящейся при температуре конденсации, отводится некоторое количество теплоты. Тогда образовавшийся (в небольшом количестве) конденсат, находящийся в контакте с оставшейся паровой фазой, будет содержать ≈19 % бензола, т.е. обогатится толуолом.
Разная склонность компонентов смесей к переходу в парообразное (либо жидкое) состояние обусловлена разницей их температур кипения. Так, температура кипения метанола 64,5 0С, а температура кипения воды 100 0С. Очевидно, что метанол будет проявлять большее стремление перейти из жидкой фазы в паровую.
Температура кипения бензола 80,2 0С, а температура кипения толуола 110,60С, значит толуол проявляет большее стремление перейти из паровой фазы в жидкую.
Различают два вида процессов перегонки: дистилляцию и ректификацию. Основное между ними различие состоит в следующем: дистилляция – процесс непротивоточный (процессы парообразования и конденсации разделены в пространстве и во времени), а ректификация – процесс принципиально противоточный.
В простейшем случае исходная смесь, подвергающаяся перегонке, является бинарной, т.е. состоит из двух компонентов (А и В). Пусть хА - мольная концентрация компонента А в жидкой фазе, а хВ- мольная концентрация компонента В в жидкой фазе; уА - мольная концентрация компонента А в паровой фазе, а уВ- мольная концентрация компонента В в паровой фазе. Тогда хА + хВ = 1, хА = 1 - хВ; уА + уВ = 1, уА = 1 - уВ.
Получаемый при испарении бинарной смеси пар обогащён, т.е. содержит большее количество легколетучего или низкокипящего (НК) компонента, чем исходная смесь. Следовательно, в процессе перегонки жидкая фаза обедняется, а паровая фаза обогащается НК. Неиспарившаяся жидкость, естественно, имеет состав, более богатый труднолетучим, или высококипящим (ВК) компонентом.
Неиспарившаяся жидкость называется кубовым остатком, а жидкость, полученная в результате конденсации паров – дистиллятом или ректификатом.
Простая перегонка (дистилляция) – это процесс однократного частичного испарения жидкой смеси и конденсации образующихся паров. Она применяется для разделения смесей, состоящих из сильно различающихся по температурам кипения компонентов. Обычно простую перегонку применяют для предварительного грубого разделения жидких смесей и для очистки смесей от нежелательных примесей.
Лекция №9
Тема: Массообменные процессы. Перегонка жидкостей (продолжение).
Цель:Охарактеризовать равновесие бинарных систем в процессах перегонки. Познакомить с видами фазовых диаграмм и с навыками их применения при расчёте процессов перегонки. Описать разновидности простой перегонки. Показать недостатки дистилляции по сравнению с ректификацией. Дать основные положения ректификации.
План
- Фазовое равновесие бинарных систем в процессах перегонки. Фазовые диаграммы.
- Разновидности простой перегонки:
а) фракционная перегонка;
б) простая перегонка с дефлегмацией;
в) перегонка с водяным паром;
г) перегонка с инертным газом;
д) перегонка под вакуумом.
3. Общая оценка процессов дистилляции.
4. Сущность ректификации.
5. Типовая схема, потоки, терминология ректификации.
Фазовое равновесие бинарных систем в процессах перегонки.
Фазовые диаграммы
Если система состоит из двух компонентов (К=2) и между ними не происходит химического взаимодействия, то при наличии жидкой и паровой фаз число фаз… Следовательно, из трёх независимых параметров, полностью определяющих… Для технических расчётов наиболее важной является диаграмма t – x,y, т.к. обычно процессы перегонки в промышленных…Разновидности простой перегонки
При периодической перегонке жидкость постепенно испаряется, и образующиеся при этом пары непрерывно удаляются из системы и конденсируются с… Простую перегонку можно проводить при атмосферном давлении или под вакуумом… Для получения нужных фракций (или разного состава дистиллята) применяют фракционную, или дробную, перегонку (рис.…Общая оценка процессов дистилляции
Чаще всего дистилляцию применяют в промышленности в тех случаях, когда не требуется высокой чистоты продукта (или полупродукта для последующих стадий производства). Высокие концентрации низкокипящего компонента можно получить лишь при большой разнице в температурах кипения компонентов разделяемой смеси. Правда, многократная дистилляция или парциальная конденсация позволяют получать достаточно чистые компоненты. Однако помимо очень низких выходов чистых продуктов эти процессы крайне невыгодны энергетически. В самом деле, здесь приходится многократно испарять уже однажды испаренную жидкость, затрачивая большое количество теплоты и теплоносителя. Одновременно приходится затрачивать хладоагент на неоднократную (повторную) конденсацию паров. Т.к. процессы парообразования разделены во времени и пространстве, дистилляция – очень длительный процесс.
Сущность ректификации
Или другими словами, ректификацию можно трактовать как совмещение процессов многократной дистилляции и многократной конденсации при противоточном… При чередовании по схеме противотока операций частичной конденсации паровой и… В процессе ректификации подводимая извне теплота затрачивается только в кипятильнике — в низу колонны однократно для…Типовая схема, потоки, терминология
Приведенная на рис. 12.22, а схема иллюстрирует лишь эффект ректификации; она ограничена получением только высококонцентрированного НК. Реальный ректификационный процесс позволяет получать оба компонента высокой концентрации.
Принципиальная схема процесса непрерывной ректификации бинарных смесей показана на рис. 12.23. Исходная смесь / подогревается в подогревателе 2 (предпочтительно до температуры кипения или близкой к ней) и через гребенку 3 (обеспечивающую возможность варьирования места подачи) подается в ректификационную колонну 1, внутри которой размещены контактные устройства (тарелки, насадка). Источником парового потока является кипятильник 4, источником жидкого потока — конденсатор 5. В схеме предусмотрены холодильники 6 и 7 продуктов, отбираемых сверху (поток II) и снизу (поток III), а также емкости исходной смеси и продуктов 8—10. Перекачивающие насосы на рисунке не показаны.
Принята следующая терминология основных потоков и узлов ректификационной установки:
— поток I носит естественное название — исходная смесь, расход её обозначается F, концентрация xF;
— поток II именуют дистиллятом (или дистиллатом), обозначается P, xP;
— поток III называют кубовым остатком (или кубовой жидкостью), обозначается W, xW;
— восходящий паровой поток IV так и называют: поток пара (иногда просто "пар"), обозначается G, yG;
— нисходящий жидкостной поток Ф (в том числе — возвращаемый сверху в колонну на орошение) именуют флегмой, обозначается Ф, хФ.
Для непрерывного проведения ректификации необходимо, чтобы поступающая на разделение смесь соприкасалась со встречным потоком пара с несколько большей концентрацией ВК, чем в жидкой смеси. Поэтому исходную смесь подают в то место ректификационной колонны, которое соответствует этому условию. Тарелку, находящуюся в сечении подачи исходной смеси в колонну 1, называют тарелкой питания. Положение тарелки питания специально рассчитывается.
Часть колонны, находящаяся выше тарелки питания (на выходе из нее получается "крепкий" НК), носит название укрепляющей части колонны. Часть колонны, находящаяся ниже тарелки питания (в ней НК отгоняется из жидкости, исчерпывается), носит название отгонной (реже — исчерпывающей) части колонны. Генератор пара называют кипятильником, источник флегмы (чаще всего — и дистиллята) — конденсатором.

Рис. 12.23. Принципиальная схема непрерывнодействующей ректификационной установки для разделения бинарных смесей: 1 — колонна, 2 — подогреватель исходной смеси. 3 — гребенка, 4 — кипятильник, 5 — конденсатор, 6, 7 — холодильники, 8— 10 — сборники;
I — исходная смесь, II — дистиллят, III — кубовая жидкость, IV — пар, V — флегма, VI — теплоноситель, VII — охлаждающий агент
Конденсация пара в конденсаторе, отбор дистиллята и возврат флегмы в колонну осуществляют двумя способами, схематично изображенными на рис. .
По первому способу (рис. , а) уходящий из колонны 1 пар полностью конденсируется в конденсаторе 2, откуда часть жидкости возвращается в колонну, а остаток выводится из системы в виде жидкого продукта. В данном случае составы всех трех потоков (пара, поступающего в конденсатор, флегмы и отводимого жидкого дистиллята) одинаковы.
По второму способу (рис. , б) уходящий из колонны 1 пар лишь частично конденсируется в конденсаторе 3, и вся образующаяся жидкость возвращается в колонну 1. Дистиллят же отводится в виде пара и при необходимости полностью конденсируется в дополнительном конденсаторе 2. В этом случае парциальный конденсатор 3 часто называют дефлегматором, а сам процесс выделения флегмы из пара — дефлегмацией. Здесь отводимый из системы продукт богаче НК, чем выходящий из колонны пар и тем более — возвращаемая в колонну жидкость.

Рис. 12.24. Схемы конденсации уходящего из колонны пара и возврата в нее части образовавшейся жидкости:
а — полная конденсация пара в конденсаторе, б - частичная конденсация пара в дефлегматоре; 1 — колонна, 2 — конденсатор, 3 — дефлегматор, 4 — гидрозатвор; I— исходная смесь, II— дистиллят, III — кубовая жидкость
Аппаратурное оформление процессов ректификации
Для проведения процессов ректификации применяются почти исключительно аппараты колонного типа. По характеру взаимодействия паровой и жидкой фаз… — со ступенчатым (дискретным) контактом фаз; — с непрерывным контактом фаз.Анализ работы ректификационных колонн и их расчёт
Допущения, принятые при расчёте ректификационных колонн 1. Молярные теплоты испарения компонентов при одной и той же температуре… 2. В дефлегматоре не происходит изменение состава пара. Следовательно, состав пара, уходящего из колонны, равен…Материальный баланс ректификационной колонны
Согласно схеме установки ректификации непрерывного действия (рис. ), в колонну поступает F кмоль исходной смеси, состав которой хF моль. долей НК. Сверху из колонны удаляется G кмоль паров, образующих после конденсации флегму и дистиллят. Количество получаемого дистиллята Р кмоль, его состав хР моль. долей НК. На орошение колонны возвращается флегма в количестве Ф моль, причём её состав равен составу дистиллята (хФ = хР моль. долей). Снизу из колонны удаляется W кмоль остатка состава xW моль. долей НК.
Тогда уравнение материального баланса колонны будет:
F + Ф = G + W
Поскольку G = P + Ф, то
F = P + W
Соответственно материальный баланс по НК:
FxF = PxP + WxW
Уравнения рабочих линий укрепляющей и исчерпывающей частей колонны
Уравнение рабочей линии верхней части любого массообменного аппарата: y = . Выведем уравнение рабочей линии укрепляющей части колонны.Построение рабочих линий на диаграмме у—х
Величину R считаем известной. Откладывая на оси ординат отрезок , соединяют прямой конец отрезка (точку d) с точкой а. Из точки, отвечающей…Минимальнре и действительное (рабочее) флегмовое число
Движущая сила, выраженная в концентрациях паровой фазы, изображается на диаграмме у—х вертикальным отрезком между данной точкой на рабочей линии и…Графический метод определения числа теоретических тарелок
Теоретическая ступень (или тарелка) – это такая ступень, которая соответствует некоторому гипотетическому участку аппарата, на котором жидкость… Число тарелок может быть определено графическим или аналитическим путем. В…Периодическая ректификация бинарных смесей
После того, как достигнут заданный состав остатка в кубе (об этом судят по температуре кипения жидкости в нём) остаток сливают, загружают куб… Периодически действующая колонна работает, подобно укрепляющей части… Процессы периодической ректификации проводятся в двух режимах:1) при постоянном флегмовом числе (R = const); 2) при…Физико-химические закономерности в химической технологии
Классификация химических реакций:
1. По фазовому составу: гомофазные и гетерофазные;
2. По механизму взаимодействия реагентов: гомогенные и гетерогенные;
3. По протеканию во времени: необратимые и обратимые;
4. По знаку теплового эффекта: экзотермические (- Δ Н) и эндотермические (+ Δ Н);
5. По использованию катализатора: каталитические и некаталитические;
6. По значению температуры: низкотемпературные и высокотемпературные;
7. По виду реакции: простые (одностадийные) и сложные (многостадийные)
Именно от типа химической реакции зависит выбор конструкции аппарата, в котором будет осуществляться процесс.
Химико-технологический процесс
В общем случае ХТП состоит из трёх последовательных стадий: I. Подготовка сырья к химической переработке; А1 ® АОсновные показатели ХТП
Степень превращения (х) – это доля исходного реагента, использованного на химическую реакцию. , Gн – общее количество исходного вещества в начале процесса; Gк – количество исходного вещества, оставшееся в конце…В нашем числовом примере
Впроп. = 25% масс., Вразл. = 66,6% масс., α= 37,5%
Впроп. =  Вразл.
Вразл.
25 = 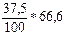
25 ≈ 24,975
Погрешность связана с тем, что выход на разложенное сырьё трудно подсчитать точно в десятичных единицах, точнее, в простых дробях.
Если показатели выразить в долях единицы:
Впроп. = 0,25
Вразл. = 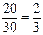 в простых дробях
в простых дробях
α = 0,375
0,25 = 0,375·
0,25 = 0,25
Таким образом, найдя по балансу продуктов два показателя процесса – конверсию сырья «α» и выход на разложенное сырьё «Вразл.», третий показатель можно посчитать по формуле (I.5). Также, зная «Впроп.» и конверсию сырья «α», можно рассчитать «Вразл.»:
Впроп. = α· Вразл (I.5)
Вразл. =Впроп .⁄α (I.6)
На практике по балансовым данным рассчитывают все три показателя и справедливость равенства (I.5) подтверждает, что показатели найдены правильно.
Значение основных показателей для характеристики промышленных процессов
Определяет производительность (П) аппарата по целевому продукту, если известна его производительность по сырью. Например: Псырьё = 600 т/сутки; Впроп. = 30% масс. Ппрод. = Псырьё · Впроп (II.1)В) α – конверсия сырья
Показывает, какая часть сырья вступает в реакцию за один проход через реактор.
Если конверсия сырья составляет 40%, следовательно, 60% сырья не успевает прореагировать. Это сырьё надо будет выделить из продуктов реакции и возвратить в процесс.
По этому показателю можно судить, какую производительность должны иметь аппараты для выделения и очстки непревращённого сырья.
Производительностью называют количество вырабатываемого продукта «G» или перерабатываемого сырья в единицу времени
П =  (кг/час или т/час) (III.1)
(кг/час или т/час) (III.1)
Если производительность цеха задана по сырью
Псырьё =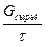 (III.2)
(III.2)
Производительность по продукту
Ппрод = (III.3)
(III.3)
Интенсивностью работы аппарата «I» называют его производительность, отнесённую к какой-либо величине, характеризующей размеры аппарата. Чаще производительность относят к объёму аппарата «V».
I = П /V (т/(м3·час)) (III.4),
где: П – производительность аппарата, т/час;
V – объём аппарата, м3.
Из выражения (III.4):
П = I · V (III.5).
Из уравнения (III.5) видно, что производительность аппарата можно повышать двумя путями:
1. При I = const. С увеличением объёма аппарата производительность увеличивается. При этом уменьшаются затраты на выработку единицы продукции за счёт экономии тепла, электроэнергии, рабочего времени.
По этому пути и шло до 80-ых годов XX века развитие химической, нефтехимической и нефтеперерабатывающей промышленности – увеличение единичной мощности агрегатов за счёт увеличения их размеров.
2. Более эффективно при V = const увеличение производительности аппарата за счёт повышения интенсивности его работы, направив усилия на совершенствование аппарата и процесса в целом.
Основная задача химической технологии
I = П /V (т/(м3·час)) (III.4),
Iпрод. = Ппрод. / V (IV.1),
где: Ппрод. – производительность аппарата по целевому продукту.
Ппрод. = Псырьё · Впроп (II.1)
где: Псырьё. – производительность по сырью;
Впроп. – выход продукта на пропрущенное сырьё.
Iпрод. =
Псырьё = (III.2)
(III.2)
Производительность по сырью показывает количество сырья G, перерабатываемое в аппарате в единицу времени.
Iпрод. = 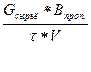
Iпрод. =  (IV.2)
(IV.2)
Если V=const. Для аппарата данной конструкции существует предельная линейная скорость подачи сырья. Поэтому при неизменных размерах аппарата V=const, и количество прерабатываемого сырья в пределе будет неизменным: V=const, Gсырьё = const.
Следовательно, (Gсырьё / V) = const. Обозначим это отношение буквой А. Тогда:
Iпрод.=
 (IV.3)
(IV.3)
Интенсивность работы аппарата будет прямо пропорциональна выходу целевого продукта на пропущенное сырьё «Впроп.» и обратно пропорциональна величине времени пребывания реагентов в зоне реакции «τ».
Можно связать интенсивность работы аппарата с выходом целевого продукта на превращённое сырьё – «Вразл.»:
Впроп. = α· Вразл (I.5)
Подставив это выражение в уравнение (IV.3), получим:
Iпрод. = А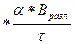
При постоянной конверсии сырья α=const.
A = const, обозначим это произведение через А´:
= const, обозначим это произведение через А´:
A = А´
= А´
и тогда:
Iпрод. = А´ (IV.4)
(IV.4)
Получим выражение, аналогичное уравнению (IV.3), только вместо выхода продукта на пропущенное сырьё фигурирует выход целевого продукта на разложенное сырьё.
Опуская в этих выражениях постоянные величины А и А´, а также значки при выходах на пропущенное и разложенное, получим формульное выражение основной задачи химической технологии:
Iпрод. = 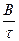 (IV.5)
(IV.5)
Основная задача химической технологии – провести процесс с максимальной интенсивностью по целевому продукту Iпрод . Интенсивность прямо пропорциональна выходу продукта и обратно пропорциональна времени пребывания реагентов в зоне реакции.
1. Выход продукта в основном зависит от термодинамических особенностей реакции. В – термодинамический критерий эффективности процесса. Чтобы его увеличить, необходимо, изменяя условия проведения реакции, сдвинуть равновесие процесса в сторону образования целевого продукта. Основные условия (термодинамические параметры), влияющие на количество получаемого продукта, - температура, давление и концентрация реагирующих веществ.
2. τ – кинетический параметр процесса. Скорость реакции обратно пропорциональна времени пребывания реагентов в зоне реакции:
w=
Из выражения (IV.5): чем меньше τ, тем выше интенсивность процесса. Для уменьшения τ мы должны реакцию провести с максимальной скоростью w.
Совокупность технологических параметров (термодинамических и кинетических) определяет технологический режим проведения химико-технологического процесса и непосредственно влияет на интенсивность процесса. Однако, решающее значение при выборе условий проведения процесса имеют вопросы скорости химических превращений, изучаемые кинетикой.
Равновесие в технологических процессах
Положение равновесия всегда зависит от внешних условий. Качественно влияние основных параметров технологического режима на равновесие определяется… Рассмотрим пример: промышленная каталитическая реакция окисления сернистого… - взять избыток одного из исходных веществ (целесообразнее брать избыток более доступного и дешёвого реагента -…Кинетика в химической технологии
Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции. Она всегда положительна, поэтому знак перед… В том случае, если реакция протекает при постоянном объёме, скорость… Численно скорость выражают в кмоль/м3·ч, моль/л·с и т.д.Пути увеличения скорости реакции
2. Влияние температуры. Экспериментально при изучении химической кинетики было обнаружено, что при увеличении температуры на 100С скорость реакции… Энергия активации реакции Е – это минимальный избыток энергии над средней… Предэкспоненциальный множитель k0 учитывает: число соударений; вероятность распада активированного комплекса реакции…Тема: Химические реактора
Цель:Познакомить с требованиями, предъявляемыми к химическим реакторам, с классификацией химических реакторов.
Главная стадия химико-технологического процесса (ХТП), определяющая его назначение и место в химическом производстве, реализуется в основном аппарате химико-технологической схемы – химическом реакторе. В технологической схеме химический реактор сопряжён с аппаратами подготоки сырья и аппаратами разделения реакционной смеси и очистки продукта. Конструкция и режим работы химического реактора определяет эффективность и экономичность всего ХТП.
Основные требования к промышленным реакторам
2. Высокий выход и наибольшая селективность процесса. Они обеспечиваются оптимальными параметрами режима: температурой, давлением, концентрацией… 3. Минимальные энергетические затраты на перемешивание и транспортировку… 4. Лёгкая управляемость, устойчивость режима и безопасность работы.Классификация химических реакторов
В основу классификации химических реакторов положены три принципа: организационно-техническая структура операций, осуществляемых в реакторе, характер теплового режима и режима движения компонентов.
По организационно-технической структуре операций химические реакторы делятся на реакторы периодического действия и реакторы непрерывного действия.
Для реакторов периодического действия характерно падение движущей силы процесса во времени вследствие уменьшения концентрации реагентов в ходе процесса. Это приводит к тому, что режим реакторов периодического действия нестационарен во времени и требует изменения параметров процесса (температура, давление и др.) для компенсации этого падения и поддержания скорости процесса на заданном уровне. Для реакторов непрерывного действия характерно постоянство движущей силы процесса во времени вследствие постоянства концентрации реагентов в ходе процесса. Поэтому режим работы реакторов непрерывного действия стационарен во времени и не требует корректировки параметров процесса.
Производительностъ реакторов рассчитывается но уравнению:
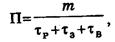
где m — масса продукта, полученная за время цикла работы реактора,
τр, τз, τв — время химического процесса, загрузки компонентов в реактор и выгрузки продуктов из реактора, соответственно.
Поскольку в непрерывном процессе τз = τв = 0, то производительность реакторов непрерывного действия выше, чем у реакторов периодического действия при прочих равных условиях.
Эффективность работы химического реактора во многом зависит от его теплового режима, влияющего на кинетику, состояние равновесия и селективность процесса, протекающего в реакторе. По тепловому режиму химические реакторы подразделяются на:
— реакторы с адиабатическим режимом, в которых отсутствует теплообмен с окружающей средой и тепловой эффект химической реакции полностью затрачивается на изменение температуры в реакторе;
— реакторы с изотермическим режимом, для которых характерно постоянство температуры в реакторе, что обеспечивается подводом или отводом тепла из реактора;
— реакторы с политропическим режимом, характеризующиеся подводом или отводом тепла из реактора при изменяющейся температуре в нем. За счет этого в реакторе устанавливается заданный тепловой режим и достигается автотермичность процесса. Реакторы этого типа наиболее распространены в химическом производстве.
Реакторы непрерывного действия. Химические реакторы непрерывного действия по режиму движения компонентов делятся на реакторы идеального вытеснения (РИВ-Н), реакторы идеального смешения (РИС-Н) и реакторы промежуточного типа (РПТ-Н).
Реакторами идеального вытеснения называются реакторы непрерывного действия, в которых осуществляются ламинарный гидродинамический режим. В них поток реагентов движется в одном направлении по длине реактора без перемешивания, обратного или поперечного перемещения. В РИВ-Н параметры, движущая сила процесса и скорость процесса изменяются по длине реактора (во времени), причем отклонение средней движущей силы от постоянного значения является максимальным.
Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них потоки реагентов смешиваются друг с другом и с продуктами химического превращения. В РИС-Н параметры, движущая сила процесса и скорость процесса постоянны по объему реактора (то есть во времени), причем отклонение средней движущей силы от постоянного значения равно нулю.
Реакторы промежуточного типа занимают по характеру изменения параметров и движущей силы процесса промежуточное место между этими крайними случаями.
Технологические схемы
Схема с открытой цепью состоит из аппаратов, через которые все реагирующие компоненты или одна из взаимодействующих фаз проходят лишь один раз… По открытой схеме строят производства, которые включают в себя необратимые или… Циклическая схема предусматривает многократное возвращение в один и тот же аппарат всех реагирующих масс или одной из…Развитие новых поколений
Высокоэффективных химико-технологических процессов.
Все это тем более парадоксально, что химия как никакая другая область предоставляет множество принципиальных возможностей и путей решения любой… Основной чертой новой технологической идеологии должен стать научный… Бесспорно, что первое место в создании новых технологий принадлежит _ катализу. Только на основе катализа можно искать…– Конец работы –
Используемые теги: Химическая, Технология, часть0.058
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Химическая технология, часть 1
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов