Равновесие в технологических процессах
Химические реакции делятся на обратимые и необратимые. Необратимые процессы протекают лишь в одном направлении. Например, реакция СО2 + Са(ОН)2®СаСО3 + Н2О практически необратима. Но гораздо большее количество химических реакций является обратимыми: наряду с химическим взаимодействием между исходными веществами (прямая реакция) протекает взаимодействие и между продуктами (обратная реакция). По мере протекания процесса скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается; в какой-то момент времени скорости прямой и обратной реакции становятся равными – наступает состояние химического равновесия. К химическому равновесию применим второй закон термодинамики в его общем виде, т.е. одним из условий химического равновесия в изолированной системе является максимум энтропии S, а также при Т и р=const условие равновесия – это минимум энергии Гиббса (dG=0).
Положение равновесия всегда зависит от внешних условий. Качественно влияние основных параметров технологического режима на равновесие определяется принципом Ле-Шателье, согласно которому: в системе, выведенной внешним воздействием из состояния равновесия, происходят изменения, направленные к ослаблению воздействий, выводящих систему из равновесия.
Рассмотрим пример: промышленная каталитическая реакция окисления сернистого ангидрида до серного 2SO2 (г)+ O2 (г) « 2SO3(г) (*). Основные условия, влияющие на количество получаемого целевого продукта – температура, давление и концентрация реагирующих веществ (сернистого ангидрида, кислорода воздуха, серного ангидрида). Для сдвига равновесия данной реакции вправо, т.е. увеличения выхода целевого продукта, согласно принципа Ле-Шателье, необходимо:
- взять избыток одного из исходных веществ (целесообразнее брать избыток более доступного и дешёвого реагента - кислорода воздуха);
- отводить продукт реакции из зоны реакции;
- реакция эндотермична, т.е. протекает с поглощением тепла, поэтому для смещения равновесия вправо необходимо подводить тепло;
- влияние давления: чувствительность положения равновесия к изменениям давления тем больше, чем большим изменением объёма сопровождается тот или иной процесс. Значительные изменения объёма могут происходить только в реакциях, в которых участвуют газы, или в тех случаях, когда хотя бы один из компонентов находится в газообразном состоянии. В нашем примере число молей продукта (SO3) меньше, чем суммарное число молей исходных реагентов. Поэтому повышение6 давления смещает равновесие реакции в сторону образования продукта.
Итак, применяя принцип Ле-Шателье, можно, не выполняя термодинамических расчётов, предсказать направление химических реакций, т.е. качественно судить о состоянии их равновесия.
Количественный подход.
1) Зависимость положения равновесия от соотношения концентраций реагирующих веществ.
Впервые зависимость направления химических процессов от концентрации реагирующих веществ установил Бекетов. В математической форме закон действующих масс был выражен Гульдбергом и Ваге.
Формулировка закона действующих масс: скорость химической реакции в данный момент прямо пропорциональна произведению концентраций реагирующих веществ.
Для реакции aA + bB « rR + sS cкорость прямой реакции w1 = k1[A]a[B]b; скорость обратной реакции w2 = k2[R]r[S]s
Константа равновесия (К) вычисляется как отношение констант скоростей прямой и обратной реакций при равновесии, т.е. при равенстве w1 = w2: k1[A]a[B]b= k2[R]r[S]s;
К = 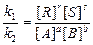
Константа равновесия не зависит от концентрации реагирующих веществ, т.к. изменение концентрации одного из веществ вызовет в состоянии равновесия изменение концентрации всех остальных веществ.
Для газов К можно выразить через парциальные давления реагирующих компонентов:
Кр = 
Рассмотрим пример: гидролиз сложных эфиров, например,
СН3-СН2-ОSO3H(ж) + HOH(ж) ↔ СН3-СН2-ОH(ж) + Н2SO4 - Q
К =  .
.
[C2H5OH] = 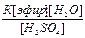 ,
,
При Т, Р = const K= const, поэтому при увеличении концентрации эфира и воды выход спирта увеличится, и при уменьшении концентрации серной кислоты выход спирта увеличится.
2) влияние температуры
Зависимость константы равновесия К от температуры выражается уравнением изобары Вант-Гоффа
 (*)
(*)
Характер этой зависимости определяется знаком теплового эффекта реакции.
Определим, как влияет температура на положение равновесия в нашем примере:
Проинтегрируем (*): 

Т.к. гидролиз сульфоэфира – реакция эндотермическая, т.е. ΔН>0, то с повышением температуры равновесие сдвигается в сторону образования продуктов реакции, т.е. увеличивается равновесная степень превращения.
Рассмотрим ещё один пример: прямая гидратация этилена
СН2=СН2 (г) + НОН (пар)↔ С2Н5ОН (пар) + Q
Качественный уровень (по принципу Ле-Шателье): равновесие сдвигается вправо при уменьшении температуры, отводе тепла, увеличении концентраций исходных веществ, уменьшении концентрации продукта реакции и увеличении давления.
Количественный уровень:  , ΔН<0, поэтому
, ΔН<0, поэтому  ,
, 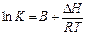 , значит, с уменьшением температуры константа равновесия увеличивается.
, значит, с уменьшением температуры константа равновесия увеличивается.
3) Влияние давления на количественном уровне.
Рассмотрим на примере прямой гидратации этилена. Т.К. все реагенты находятся в газообразном состоянии, то запишем К для данной реакции через парциальные давления
Кр =  .
.
По закону Дальтона: Рспирт + Рэтен + Рвода = Робщ,
(Рспирт/ Робщ) + (Рэтен/ Робщ) + (Рвода/ Робщ) =1.
При равновесии (Рспирт*/ Робщ) = const = xp, где Рспирт* - равновесное парциальное двление спирта; xp – равновесная степень превращения.
Рспирт* = xp· Робщ.
(Рэтен/ Робщ) + (Рвода/ Робщ) =1 - xp,
(Рэтен/ Робщ) = (Рвода/ Робщ) - т.к. стехиометрические коэффициенты равны.
2(Рэтен/ Робщ) =1 - xp,
Рэтен* =  (1 - xp) Робщ, Рвода* =
(1 - xp) Робщ, Рвода* =  (1 - xp) Робщ.
(1 - xp) Робщ.
Подставим найденные равновесные парциальные давления в выражение для Кр:
Кр =  .
.
При синтезе спирта в промышленных условиях хр<<1, хр = 0,04, поэтому этой величиной в формуле для Кр можно пренебречь, следовательно (1 - хр)≈ 1, тогда Кр =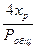 , хр = (Кр · Робщ)/4, т.е. чем больше давление, тем больше равновесная степень превращения. Таким образом можно получить уравнения, связывающие хр и Кр для любой обратимой реакции.
, хр = (Кр · Робщ)/4, т.е. чем больше давление, тем больше равновесная степень превращения. Таким образом можно получить уравнения, связывающие хр и Кр для любой обратимой реакции.