Кинетика в химической технологии
В случае гомогенной химической реакции w=± , где w – скорость химической реакции; ni – количество (в молях) одного из реагентов (или продуктов); τ – время; V – реакционный объём.
, где w – скорость химической реакции; ni – количество (в молях) одного из реагентов (или продуктов); τ – время; V – реакционный объём.
Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции. Она всегда положительна, поэтому знак перед производной dni/dτ должен определяться тем, является ли вещество I исходным реагентом (тогда dni/dτ отрицательна) или продуктом (тогда dni/dτ положительна).
В том случае, если реакция протекает при постоянном объёме, скорость определяют как изменение молярной концентрации сi в единицу времени w=±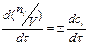 ,
,
Численно скорость выражают в кмоль/м3·ч, моль/л·с и т.д.
Скорость химического превращения зависит от большого числа переменных. На скорость влияют на только факторы, определяющие состояние химического равновесия (Т, Р, состав реакционной смеси), но и иные причины. Установлено, что, во-первых, скорость химической реакции пропорциональна концентрации реагентов.
Пусть уравнение необратимой одностадийной реакции имеет вид:
аА + bВ→rR + sS.
Кинетическое уравнение этой реакции (согласно закону действующих масс) w = kcAacBb, где k – константа скорости химической реакции, её физический смысл состоит в том, что она равно скорости химической реакции, когда концентрации исходных реагентов равны между собой и равны 1.
Во-вторых: суммарная скорость нескольких последовательных превращений, сильно различающихся по скорости, определяется скоростью наиболее медленной (лимитирующей) стадии.