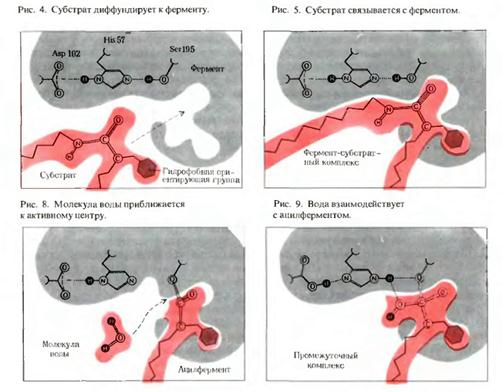
Ферменты понижают энергию активации химической реакции
1) Как и любые катализаторы, ферменты повышают скорость химической реакции за счёт снижения энергии активации реакции (энергетического барьера) реакции.
2) Снижение энергии активации при ферментативном катализе обусловлено увеличением числа стадий химического процесса.
Индуцирование ряда промежуточных стадий приводит к тому, что исходный барьер энергии активации (Еа) дробится на несколько более низких барьеров энергии активации, преодолеть которые реагирующие молекулы могут гораздо быстрее, чем основной.
3) Ферменты помогают субстратам принять переходное состояние за счет энергии связывания при образовании фермент-субстратного комплекса. Так, при образовании водородных связей между субстратом и ферментом при фиксации субстрата на поверхности фермента выделяется энергия (Еа), которая затрачивается на перевод молекул субстрата в активное состояние.
Условная запись реакции образования и функционирования фермент-субстратного комплекса выглядит следующим образом:
E + S ↔ ES → EP → E + P
При взаимодействии фермента с субстратом можно выделить три стадии:
1. Первая стадия: образование фермент-субстратного комплекса,
т. е. присоединение субстрата к макромолекуле фермента.
2. Вторая стадия: непосредственно ферментативная реакция.
3. Третья стадия: отделение продуктов превращения субстрата от фермента.
Первая стадия - образование фермент-субстратного комплекса
(E + S ↔ ES):
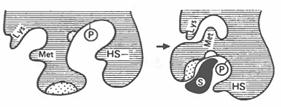
1) Взаимодействию фермента с субстратом предшествует сближение и ориентация субстрата по отношению к активному центру фермента.
2)Затем образуются фермент-субстратные (ES) комплексы.
Тонкий механизм формирования фермент-субстратного комплекса:
а) при формировании фермент-субстратного комплекса обратимо меняется третичная структура (конформация) фермента, что способствует наилучшему пространственному соответствию молекул фермента и субстрата (рис. 3.5):