Короткі відомості
Кислотність відображає якісні та технологічні властивості сировини, напівфабрикатів і готової продукції. Вона характеризується наявністю кислот і кислореагуючих речовин у продуктах й виражається в градусах, під якими розуміють кількість кубічних сантиметрів нормального розчину лугу NaOH або КОН, що йде на нейтралізацію кислот та кислореагуючих речовин у 100 г продукту.
Якщо продукти мають лужну реакцію, вони відповідно характеризуються показниками лужності,який виражають кількістю кубічних сантиметрів нормального розчину кислоти HCl або H2SO4, необхідної для нейтралізації лужнореагуючих речовин у 100 г продукту.
Існує кілька методів визначення загальної (титрованої) кислотності (титрування бовтанки, витяжки). Титрування проводять з індикаторами або електрометрично, якщо темний колір продукту не дає змоги встановити зміну кольору індикатора в кінці реакції.
Крім титрованої, інколи потрібно знати активну кислотність, яка характеризується показником рН і визначається за допомогою потенціометрів. Теоретичні основи методу викладені у працях [ 6, 62–65, 144–148; 1, с. 134–140; 7, с. 114–117].
Розчини, застосовані для титрування, з точною, раніше встановленою, концентрацією називають стандартними або титрованими розчинами. Концентрацію розчину виражають через його нормальність, молярність або титр.
Титром Т розчину називають кількість грамів розчиненої речовини, що міститься в 1 см3 розчину. Наприклад, ТNaCl = 0,005844 г/см3 означає, що 1 см3 даного розчину хлориду натрію містить 0,005844 г NaCl.
Титр розчину можна визначити через нормальність розчину, г/см3:
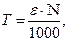 (6.1)
(6.1)
де e – грам-еквівалент (г-екв) – кількість речовини в грамах, еквівалентна (хімічно рівноцінна) грам-атому або грам-іону водню в даній реакції, г; N – нормальність розчину.
Титр даного стандартного розчину можна виразити в грамах або міліграмах іншої речовини, тобто визначити, якій ваговій кількості даної речовини відповідає 1 см3 стандартного розчину.
Тоді титр вираховують за формулою
 (6.2)
(6.2)
де  – грам-еквівалент речовини, за якою визначають титр;
– грам-еквівалент речовини, за якою визначають титр; 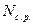 – нормальність стандартного розчину.
– нормальність стандартного розчину.
Наприклад, Т0,1 моль/дм3  =
= = 0,0040 г/см3, читають так: титр 0,1 моль/дм3 розчину сірчаної кислоти за гідроксидом натрію дорівнює 0,0040 г/см3. Це означає, що 1 см3 0,1 моль/дм3 розчину сірчаної кислоти вступає в реакцію з 0,0040 г їдкого натрію.
= 0,0040 г/см3, читають так: титр 0,1 моль/дм3 розчину сірчаної кислоти за гідроксидом натрію дорівнює 0,0040 г/см3. Це означає, що 1 см3 0,1 моль/дм3 розчину сірчаної кислоти вступає в реакцію з 0,0040 г їдкого натрію.
Інколи для визначення точної концентрації титрованих розчинів користуються поправочним коефіцієнтом або поправкою К, яка відображає відношення нормальності даного розчину до точно визначеної нормальності. Як правило, застосовують розчини такої нормальності, щоб поправка до їх концентрації була близькою до одиниці.
Поправка показує, на яке число треба помножити об’єм даного розчину, щоб привести його до об’єму розчину певної нормальності. Наприклад, 0,1 моль/дм3 розчин HCl за умови К = 1,146 у 1,146 разів більш концентрований, ніж 0,1 моль/дм3 розчин, і, відповідно, 1 см3 такого розчину відповідає 1,146 см3 0,1 моль/дм3 розчину.
Поправку можна розрахувати:
а) як відношення титру приготованого розчину до титру розчину певної нормальності:
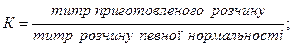 (6.3)
(6.3)
б) якщо відома наважка розчиненої речовини і об’єм розчину, поправку К обчислюють із співвідношення:
 , (6.4)
, (6.4)
Кислотність деяких продуктів виражається в міліграм-відсотках тієї чи іншої кислоти на 100 г продукту, для чого показник кислотності в градусах множать на величину міліграм-еквівалента відповідної кислоти [6, с.144].
У табл. 6.1 наведено значення міліграм-еквівалентів деяких харчових кислот.