Короткі відомості
Для проведення роботи беруть один із зразків готової продукції (булочний, здобний або бубличний виріб) і визначають кількість цукру перманганатним і йодометричним методами згідно з методиками ДСТУ 7045:2009 «Вироби хлібобулочні».
Техніка визначення масової частки сахарози в булочних і здобних виробах викладено у працях [4, с. 286; 5, с. 237]. Хімізм цих методів висвітлений у працях [1, с.77; 3, с.69]. На жаль, у рекомендованій літературі ці питання не узагальнено, тому надаємо основні пояснення суті та хімізму цих методів.
Суть хімічних методів визначення масової частки цукру в харчових продуктах полягає в переведенні сахарози в розчин, гідролізі сахарози з утворенням редукувальних цукрів і окисненні останніх оксидами важких металів або йодом у лужному середовищі. Серед металів як окисники використовують оксид міді (ІІ), оксид заліза (ІІІ). Найпоширенішими є методи, які базуються на окисленні цукрів оксидом міді (ІІ): перманганатний метод (метод Бертрана), напівмікрометод ВНИИХП, метод гарячого титрування, які входять у стандарт для визначення масової частки сахарози в булочних виробах, метод Лейна і Ейнона – у кондитерських виробах. Вивчаючи ці методи, слід особливу увагу звернути на їх хімізм.
На першому етапі хімізм названих методів однаковий і полягає в тому, що як джерело оксиду міді (ІІ) використовують рідину Фелінга, одержану змішуванням двох розчинів: Фелінга І (розчину CuSO4) і Фелінга ІІ (лужного розчину тартрату калію-натрію – сегнетової солі). Під час змішування цих розчинів спочатку утворюється блакитний осад гідроксиду міді, який одразу розчиняється в результаті утворення комплексної сполуки міді й сегнетової солі:
CuSO4+2NaOH=Cu(OH)2¯+Na2SO4; (14.1)

Комплексна сполука – нестійка і під час нагрівання в присутності редукувальних цукрів розпадається з утворенням окисника CuO.
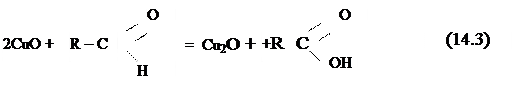 |
У результаті реакції з цукрами утворюється осад Cu2O, кількість якого еквівалентна кількості цукрів, що прореагували:
Проте для реакції окиснення цукрів характерні різний ступінь окиснення й утворення різних продуктів окиснення, склад яких залежить від природи цукрів, умов проведення аналізу тощо. Крім того, реакція супроводжується побічними процесами – руйнуванням цукрів під час нагрівання в лужному середовищі, їх окисненням під дією кисню повітря. Тому для визначення кількості цукрів за знайденою кількістю міді користуватися стехіометричним рівнянням не можна – потрібні спеціальні таблиці, складені дослідним шляхом для кожного методу і кожного виду цукрів.
У подальшому методи розрізняють за способом визначення кількості міді, що вступила в реакцію окислення цукрів.
Робота 14.1.Визначення масової частки цукру в булочних виробах перманганатним (арбітражним) методом
Порядок виконання роботи
За перманганатним методом осад Cu2O відокремлюють фільтруванням і визначають кількість оксиду міді (І). Для цього його розчиняють у кислому розчині сульфату заліза (ІІІ), яке при цьому відновлюється до сульфату заліза (ІІ) і відтитровується перманганатом калію:
Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O; (14.5)
10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O. (14.6)
Знаючи кількість розчину перманганату калію, який пішов на титрування, і титр розчину за міддю, можна розрахувати кількість міді, відновленої під час окиснення цукрів. За спеціальними таблицями, складеними дослідним шляхом, за знайденою кількістю міді визначають кількість відповідного виду цукрів (сахарози або інвертних цукрів, мальтози, глюкози).
Особливу увагу треба звернути на методику визначення титру KMnO4 за міддю [1, с. 80].
Титр марганцевокислого калію можна обчислити, виходячи з наведених вище рівнянь реакції, й перевірити титруванням 0,4965 г щавлевої кислоти у присутності 10 см3 H2SO4 перманганатом [1, с. 80].
ДСТУ 7045:2009 “Вироби хлібобулочні. Методи визначання фізико-хімічних показників» передбачає визначення титру розчину марганцевокислого калію таким методом: на аналітичних вагах зважують близько 0,14 г щавлевокислого амонію і нагрівають у фарфоровій чашці з 100 см3 води і 2 см3 концентрованої сірчаної кислоти на водяній бані до температури 60–80° С, користуючись замість палички для розмішування термометром, і титрують з бюретки розчином марганцевокислого калію при постійному помішуванні до появи рожевого забарвлення.
Титр розчину KMnO4 за міддю (І) обчислюють за формулою:
Т =  (14.7)
(14.7)
де m – маса щавлевокислого амонію, г; V – об’єм розчину марганцевокислого калію, що пішов на титрування, см3; 0,8951 – коефіцієнт перерахунку щавлевокислого амонію на мідь.
Коефіцієнт перерахунку щавлевокислого амонію на мідь можна розрахувати таким чином: виходячи з рівнянь (14.5) і (14.6), дві молекули перманганату калію відповідає десяти атомам міді, тобто 2KMnO4 – 10Cu+. Водночас взаємодія перманганату калію з щавлевокислим амонієм при визначенні титру KMnO4 відбувається згідно з рівнянням:
2KMnO4+5(NH4)2C2O4+8H2SO4=2MnSO4+K2SO4+5(NH4)2SO4+10CO2+8H2O (14.8)
З цього можна зробити висновок:
1(NH4)2C2O4 ® 2Cu+;
М – 142,12; М=2·63,6.
Якщо відома маса m, г, відтитрованого перманганатом щавлевокислого амонію, кількість міді можна визначити з пропорції:
| 142,12 | – 2´63,6 |
| m | – Х |

де 0,8951 – коефіцієнт перерахунку (NH4)2C2O4 на мідь.
Титр KMnO4 можна також встановити, титруючи свіжоперекристалізовану щавлеву кислоту чи щавлевокислий натрій, звільнений від гігроскопічної води. У цьому разі використовують коефіцієнти 1,0086 і 0,9488, відповідно, для щавлевої кислоти та щавлевокислого натрію [4, с. 310].
Для проведення роботи беруть один із зразків готової продукції (булочний, здобний або бубличний виріб) і визначають кількість цукру перманганатним і іншими методами згідно з методиками ДСТУ 7045:2009 «Вироби хлібобулочні. Методи визначення фізико-хімічних показників».
Зразок до аналізу готують відповідно до інструкції [4, с. 286]. Слід всі операції здійснювати дуже швидко, не допускаючи завітрювання та висихання продукції.
Підготовлений зразок поміщають у закриту чашку. Відбір величини наважки, приготування водної витяжки і гідроліз сахарози проводять відповідно до методик, викладених у праці [2, с. 301–302; 4, с. 288, 7, с. 162].
Для осадження білкових речовин до витяжки додають розчини ZnSO4 та NaOH в еквівалентних кількостях, тому перед початком досліду потрібно перевірити їх співвідношення титруванням (до 10 см3 ZnSO4 додають кілька крапель фенолфталеїну та титрують NaOH).
Для перерахунку результатів вмісту цукру на абсолютно сухі речовини масову частку вологи у виробах визначають на приладі ВНИИХП–ВЧ. Приготовану водну витяжку використовують для визначення цукру різними методами.
Визначення цукру перманганатним методом здійснюють за методикою, викладеною у праці [2, с. 301, 7, с. 162]. Треба мати на увазі, що правильні результати можна одержати лише у разі чіткого дотримання всіх вимог методики.