Дослiд 18.3. Властивостi пiридину
| Реактиви та матеріали: | пiридин, 0,1Н розчин хлориду залiза FeCl3, насиче-ний розчин пiкринової кислоти, карбонат натрiю (0,1Н розчин), перманганат калiю (0,1Н розчин), сода, червоний лакмусовий папірець |
| Обладнання: | мiкроскоп, предметне скло, пiнцет, пробiрки, паль-ник |
1. Розчиннiсть пiридину у водi. В пробiрку вносять краплю пiридину i 5 крапель води. Утворюється прозорий розчин. Пiридин добре розчиняється у водi.
2. Основний характер пiридину. За допомогою пiнцета смужку червоного лакмусового паперу вносять у пробiрку з розчином пiридину - папiр стає синiм.
Хiмiзм процесу:
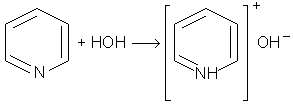
Пiридин у водному розчинi утворює з водою основу, яка дисоцiює з утворенням гiдроксид iону. Константа iонiзацiї пiридину 2 . 10-9, i водний розчин його має лише слабку лужну реакцiю.
Основнi властивостi пiридину пояснюються присутнiстю неподiленої електронної пари у атома азоту:
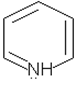
Через пiдвищену електронну густину бiля атома азоту можна було б сподiватись сильних основних властивостей пiридину. Але пiридин дуже слабка основа. Це зумовлено поєднанням вiльної електронної пари азоту з p-електронною системою пiридину.
3. Осадження гiдрооксиду залiза Fе(ОН)3 розчином пiридину. У пробiрку вносять 2 краплi розчину пiридину i краплю розчину хлориду залiза. Випадають пластiвцi гiдроксиду залiза (III):
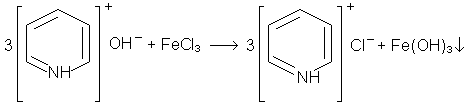
хлористоводнева
сіль піридину
Пiридин утворює солi з одним еквiвалентом кислоти. Вiн зв'язує соляну кислоту, яка утворюється при гiдролiзi хлориду залiза, i при цьому зрушує рiвновагу цiєi реакцiї до випадання гiдроксиду залiза.
4.Стiйкiсть пiридину до дiї окислювачiв. В пробiрку вносять краплю розчину пiри-дину, краплю розчину перманганату калiю i краплю розчину соди. Сумiш у пробiрцi ретельно перемiшують i нагрiвають у полум'ї пальника. Колiр перманганату калiю не змiнюється, бо пiридин стiйкий до дiї окислювачiв. Пiридин схожий з бензолом, при-чому пiридинове ядро бiльш стiйке до дiї окислювачів, нiж бензольне.
5. Стійкість піридину до дії окисників. У пробірку вміщують 1 краплю розчину перманганату калію й 1 краплю розчину соди. Вміст пробірки ретельно перемішують і нагрівають на полум¢ї пальника. Колір перманганату калію не змінюється, так як піридин стійкий до дії окисників. Піридин подібний з бензолом, причому піридинове ядро більш стійке до окиснення, ніж бензольне.
6.Утворення пікрату піридину. У пробірку вміщують 1 краплю водного розчину піридину й 4-5 крапель насиченого водного розчину пікринової кислоти. При перемішуванні вмісту пробірки випадають гарні голчасті кристали пікрату піридину, розчинні в надлишку піридину. Частину кристалів кладуть на предметне скло й розглядають під мікроскопом. Утворення пікрату підтверджує основні властивості піридину. Температура плавлення пікрату піридину 167°С.