Дослід 3.1. Визначення вуглецю пробою на обвуглювання
| Реактиви та матеріали: | глюкоза кристалічна або цукор, казеїн, сірчана кис-лота (0,1Н розчин), фільтрувальний папір |
| Обладнання: | скальпель або кришка тигля, пальник |
Присутність вуглецю в багатьох органічних речовинах можна спостерігати по обвуглюванню речовини при обережному прожарюванні.
На кінчик скальпеля або кришку тигля вміщують декілька кристалів глюкози (цукру) і обережно нагрівають у полум’ї пальника. Глюкоза розплавляється, темніє і загоряється. На скальпелі зостається обвуглена чорна маса - вуглець. Отже, глюкоза є органічною речовиною.
На кінчик скальпеля вміщують крупинку казеїну і обережно нагрівають у полум’ї пальника. Казеїн спучується, обвуглюється і загоряється. На кінчику скальпеля зостається чорна маса - вуглець. Отже, білки є органічними речовинами. При згорянні білків відчувається характерний запах спаленого волосся. Іноді обвуглювання спостерігається також при дії на органічні речовини (цукор, крохмаль, клітковину, спирти тощо) водонагрівальних речовин, наприклад, концентрованої сірчаної кислоти. Особливо сильно обвуглювання проявляється при нагріванні. При цьому обвуглювану дію проявляє навіть розбавлена сірчана кислота.
На шматочок фільтрувального паперу (клітковини) вміщують краплю розчину сірчаної кислоти. Після висихання на папері не залишається сліду. Обережно піді-грівають папір над полум’ям пальника. Ділянка фільтрувального паперу, який змочу-вали сірчаною кислотою, обвуглюється раніше, ніж чистий папір. Отже, і клітковина належить до органічних речовин.
Проба на обвуглювання - це тільки допоміжний спосіб визначення вуглецю у досліджуваному розчині, бо вона достовірна тільки при наявності обвуглювання; якщо обвуглювання не виникає, то це не дає права робити висновок про відсутність вуг-лецю в речовині, тому що ряд речовин не може обвуглюватись звичайним способом. Деякі органічні речовини випаровуються раніше, ніж встигають обвуглитися; інші (сечовина, фталевий ангідрид) сублімують. Тому найбільш загальним методом визна-чення вуглецю і одночасно з ним водню є згоряння органічної речовини в суміші з окисником, в ролі якого використовують дрібний порошок оксиду міді.
Визначення вуглецю і водню спаленням речовини з оксидом міді (II)
Принцип методу полягає в тому, що при прожарюванні речовини, змішаної з чорним порошком оксиду міді (II) CuО, вуглець, згоряючи за рахунок кисню, дає оксид вуглецю (IV), а водень речовини утворює воду. Оксид міді (II) при цьому частково відновлюється до металічної міді.
Схематично процес можна виразити таким чином:
(С...Н...) + 3CuО ® CO2 + H2O + 3Cu
Практично завжди беруть надлишок оксиду міді для того, щоб речовина повністю згоріла і не було нестачі вуглецю у вигляді оксиду вуглецю (II), який не утворює осаду з баритовою водою.
Для встановлення наявності СО2 використовують відому реакцію з баритовою водою, яка дає білий осад карбонату барію при пропусканні крізь неї оксиду вуглецю (IV):
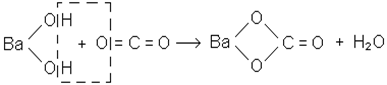
Для визначення присутності води використовують безводний сульфат міді. Білий порошок безводного сульфату міді CuSO4 синіє при попаданні на нього води, яка перетворює його в синій кристалогідрат
CuSO4+ 5Н2О = CuSO4 × 5Н2О (мідний купорос)
білий синій
| Для проведення експерименту в пробірку (рис. 3.1) насипають чорний порошок оксиду міді на висоту близько 10 мм. Додають лопаточку сахарози і ретельно перемішують, енергійно струшуючи пробір-ку. В верхню частину пробірки 1 вводять у вигляді проб-ки невеликий жмутик вати, на яку насипають тонкий шар білого порошку - зневодненого мідного купо-росу. Закривають пробірку 1 пробкою з газовідвід- ною трубкою. При цьому кінець трубки повинен майже впиратися у вату з CuSO4. Нижній кінець трубки вмі- | 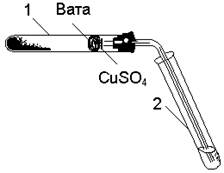 Рис. 3.1. Визначення вуглецю
і водню
Рис. 3.1. Визначення вуглецю
і водню
|
щують у пробірку 2, попередньо наливши в неї близько 5 мл баритової води.
Пробірку 1 нагрівають на полум’ї пальника. Якщо пробка щільно закриває про-бірку, то через декілька секунд із газовідвідної трубки почнуть виходити бульбашки газу. Як тільки баритова вода стане каламутною внаслідок виділення білого осаду BaCO3, пробірку 2 слід вийняти. Тримаючи за газовідвідну трубку, продовжують нагрівати пробірку 1 по всій довжині до вати, доки пари води не досягнуть білого порошку зневодненого мідного купоросу, який знаходиться на ватному тампоні, і не викличуть посиніння його внаслідок утворення кристалогідрату CuSO4 × 5H2O. Якщо взяти дуже великий шматок вати, вона поглине пари води, які виділяються, і посиніння може не відбутися.
Встановивши наявність СО2 і Н2О, визначають в розчині вуглець і водень. Вказані елементи не містилися в добавленому оксиді міді, а отже, вони могли знаходитись тільки в органічній речовині, яку брали для аналізу.
Цей же принцип лежить в основі кількісного елементного аналізу органічних речовин з тією різницею, що береться певна наважка досліджуваної речовини і, крім того, визначається маса утворених СО2 і Н2О. На основі отриманих даних роз-раховують спочатку процентний вміст вуглецю і водню в речовині, а потім, після визначення молекулярної маси, виводять найпростішу, так звану елементну формулу речовини.