Увага! Дослід проводити у витяжній шафі.
У суху пробірку вміщують 4 краплі суміші рідких алканів і додають 1-2 краплі розчину брому. Суміш перемішують на холоді. Забарвлення брому при цьому не зникає. Потім пробірку нагрівають до зникнення забарвлення. В отвір пробірки вносять скляну паличку, змочену розчином аміаку, - з’являється білий димок NH4Br. Пінцетом вносять у пробірку змочений водою лакмусовий папірець - він червоніє.
Хімізм процесу:
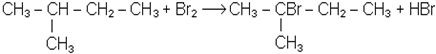
2-бром-2-метилбутан
Бромування рідких алканів супроводжується виділенням бромистого водню і відбувається значно повільніше, ніж газоподібних алканів. Реакція прискорюється при використанні каталізаторів: залізних ошурок, кристалічного йоду.
Найлегше галогенуються вуглеводні з третинним атомом вуглецю в молекулі, найважче заміщуються атоми водню при первинному атомі вуглецю. Енергія s-зв’язку водню з первинним атомом вуглецю дорівнює 99 ккал/моль; вторинним - 94 ккал/моль (389 кДж/моль); третинним - 90 ккал/моль (376,8 кДж/моль). Різниця в швидкості реакції галогенування особливо виявляється при дії брому.
Реакції окиснення широко використовуються в органічній хімії для синтезу різних кисневмісних з'єднань.
Механізм окиснення в залежності від природи окисника, субстрату й умов проведення реакції може бути різним.