Будова, ізомерія, номенклатура, властивості
Вуглеводні з подвійним зв’язком називаються етиленовими (олефінами, ал-кенами). Вони мають загальну формулу СnН2n.
За міжнародною номенклатурою назву алкену утворюють таким чином: вибирають найдовший ланцюг вуглецевих атомів з подвійним зв’язком і закінчення алканів “-ан” замінюють на “-ен”. Відлік вуглецевих атомів починають з кінця, ближнього до подвійного зв’язку. Називають розгалуження, вказуючи цифрами їхнє розташування, потім основний ланцюг із закінченням “-ен“ і вказують цифрою місце, де починається подвійний зв’язок:
| Н2С = СН - СН3 | 
|
| пропен | 4-метилпентен-2 |
Молекули з двома подвійними зв’язками належать до класу алкадієнів, які називають, додаючи перед закінченням частку “ді-”:

бутадієн - 1,3
Дуже часто алкени називають без урахування розгалуження (за винятком бути-лену), використовуючи закінчення “-илен”: С2Н4-етилен, С3Н6-пропілен, С4Н8-бутилен та ізобутилен (розгалужений вуглеводень), С5Н10-амілен або пентілен - так можна назвати будь-який з ізомерів С5Н10.
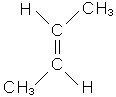
У всіх ненасичених вуглеводнів існують два види ізомерії: ланцюга і розта-шування кратного зв’язку. Крім того, етиленові вуглеводні, які мають різноманітні (щонайменше два) радикали біля атомів вуглецю, поєднаних подвійним зв’язком, можуть існувати у вигляді просторових ізомерів залежно від розташування радикалів щодо подвійного зв’язку. Цей вид ізомерії називається цис-транс-ізомерією, або геометричною. У цис-ізомера однакові радикали розташовані по один бік від площини подвійного зв’язку, у транс-ізомера - по різні.
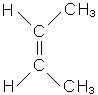
| 
|
| цис-бутен-2 | транс-бутен-2 |
Для ненасичених вуглеводнів характерні реакції приєднання (головним чином, електрофільного), окиснення і полімеризації.
У алкенів спостерігається в ІЧ-спектрах характерне поглинання при 3100, 1420 і 915 см-1 (=С-Н) і 1650 см-1 (валентні коливання -С=С-, коли подвійний зв’язок роз-міщується на кінці ланцюга).