Дослiд 7.2. Синтез нiтробензолу
| Реактиви та матеріали: | бензол, азотна кислота, сiрчана кислота (d=1,84 г/см3) |
| Обладнання: | водяна баня, термометр, пробiрки |
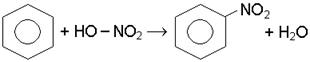
В суху пробiрку наливають 2 краплi концентрованої азотної кислоти i 3 краплi концентрованої сiрчаної кислоти. Отриману нiтруючу сумiш охолоджують i додають 2 краплi бензолу. Пробiрку вмiщують у водяну баню, пiдiгрiту до 50-55°С на 2-3 хв, постiйно струшуючи її вмiст. Пiсля цього виливають реакцiйну сумiш в ранiше приготовлену пробiрку з водою. На дно опускається крапля важкого жовтуватого нiтробензолу, каламутного вiд присутностi вологи.
Хiмiзм процесу:
Активною формою нiтруючого агента є катiон нiтронiю, який утворюється при дiї сiрчаної кислоти на азотну: НNO3 + 2H2SO4 
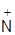 O2 + 2HSO4- + [H3O]+. Iон гiдроксонiю [H3O]+, або
O2 + 2HSO4- + [H3O]+. Iон гiдроксонiю [H3O]+, або 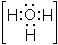 , утворюється iз протона Н+ i молекули води у водних розчинах мiнеральних кислот. Катiон нiтронiю реагує з ароматичними вуглеводнями:
, утворюється iз протона Н+ i молекули води у водних розчинах мiнеральних кислот. Катiон нiтронiю реагує з ароматичними вуглеводнями:
C6H6 + 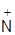 O2 ® [C6H6 ®
O2 ® [C6H6 ®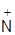 O2] ® [C6H5 - HNO2]
O2] ® [C6H5 - HNO2] 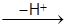 C6H5 - NO2
C6H5 - NO2
бензол p–комплекс s-комплекс нітробензол
Швидкiсть реакцiї нiтрування залежить вiд об’єкта нiтрування та складу нiтру-ючої сумiшi. Для кожної сполуки iснує оптимальний склад.