Дослiд 9.5. Синтез дiетилового ефiру
| Реактиви та матеріали: | етиловий спирт 96%-ний, сульфатна кислота |
| Обладнання: | пробiрки, пiпетки, пальник |
У суху пробiрку вносять 2 краплi етилового спирту i 2 краплi сульфатної кислоти. Сумiш обережно нагрiвають над полум’ям пальника, поки розчин стане бурим. До гарячої сумiшi обережно додають ще 2 краплi етилового спирту. Відчувається харак-терний запах дiетилового ефiру.
Хiмiзм процесу:
C2H5OH + HOC2H5 ® C2H5 - О - C2H5 + H2O
Реакцiя проходить у двi стадiї. Спочатку спирт реагує з сульфатною кислотою, утворюючи кислий складний ефiр сульфатної кислоти - етилсульфат, або етилсульфатну кислоту:
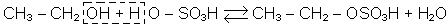
Якщо спирт береться в надлишку, то на другiй стадiї утворюється простий ефiр - дiетиловий ефiр:
CH3 - CH2 - O - SO3H + HO - CH2 - CH3 ® CH3 - CH2 - O - CH2 - CH3 + H2SO4
Коли ж у реакцiю вступає вiдносно багато сульфатної кислоти i мало спирту, то при подальшому нагрiваннi (до 160°С) утворюється олефiн.
Al2O3
СН3-СН2-СН2ОН ® СН3-СН=СН2 + Н2О
Отже, в залежностi вiд температури реакцiї i кiлькiсних спiввiдношень спирту i сульфатної кислоти можливi два випадки дегiдратацiї:
- з утворенням етиленового вуглеводню (внутрiшньомолекулярна дегiдра-тацiя);
- з утворенням простого ефiру (мiжмолекулярна дегiдратацiя).
Дослiд 9.6. Утворення етилацетату(оцтовоетилового ефіру).
У суху пробірку покладіть небагато (висота шару приблизно 2 мм) порошку зневодненого ацетату натрію й 3 краплі етилового спирту. Додайте 2 краплі концентрованої сульфатної кислоти (у витяжній шафі) та нагрівайте обережно над полум'ям пальника. Через декілька секунд з'являється характерний приємний освіжаючий запах оцтовоетилового ефіру. Хід реакції:
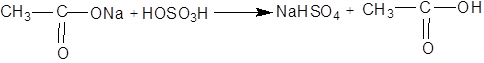
C2H5OH + HOSO3H ↔ H2O + C2H5OSO3H

Оцтовий ефір або етилацетат – туалетний оцет, використовуєься як розчинник. Реакція використовується для відкриття етилового спирту (за запахом ефіру).
Дослiд 9.7. Взаємодiя глiцерину з гiдроксидом мiдi (II)
| Реактиви та матеріали: | глiцерин, сульфат мiдi (0,2М розчин), їдкий натр (2Н розчин) |
| Обладнання: | пробiрки, пiпетки |
У пробiрку вносять 2 краплi розчину сульфату мiдi, 2 краплi розчину їдкого нат-ру i перемiшують - утворюється блакитний драглистий осад гiдроксиду мiдi (II). Дода-ють краплю глiцерину i розмiшують. Осад розчиняється i з’являється темно-синiй колiр внаслiдок утворення глiцерату мiдi.
Хiмiзм процесу:
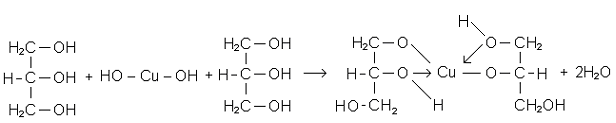
Глiцерин - трьохатомний спирт. Кислотнiсть його бiльша, нiж одноатомних спиртiв; збiльшення числа гiдроксильних груп пiдвищує кислотний характер.
Глiцерин легко утворює глiцерати з гiдроксидами важких металiв. Але здатнiсть його утворювати металiчнi похiднi (глiцерати) з багатовалентними металами поясню-ється не стiльки його пiдвищеною кислотнiстю, скiльки тим, що при цьому утворю-ються внутрiшньокомплекснi сполуки, якi вiдзначаються особливою стiйкiстю. Спо-луки такого типу часто називають хелатними (вiд грецького “хела” - клешня).