Будова, iзомерiя, номенклатура i властивостi
Альдегiди i кетони - похiднi вуглеводнiв, якi мiстять карбонiльну, або оксо-групу -  . В альдегiдах вона зв'язана з радикалом та воднем
. В альдегiдах вона зв'язана з радикалом та воднем  , в кетонах - з двома радикалами
, в кетонах - з двома радикалами 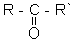 , або CпН2п+1СОН для альдегiдiв i СрН2р+1-С(О)-СqH2q+1
, або CпН2п+1СОН для альдегiдiв i СрН2р+1-С(О)-СqH2q+1
для кетонiв. Iзомерiя альдегiдiв i кетонiв залежить вiд iзомерiї вуглецевого скелета,
крiм того, у кетонiв - вiд положення карбонiльної групи.
Альдегiди називають по тих кислотах, в якi вони перетворюються при окисненнi. Так, мурашиний (формальдегiд) окиснюється в мурашину кислоту, оцтовий (ацетальдегiд) - в оцтову кислоту i т.д. Для альдегiдiв з розгалуженим радикалом часто за основу беруть оцтовий альдегiд.
Кетони за рацiональною номенклатурою називають, додаючи до назви обох радикалiв слово "кетон". За мiжнародною номенклатурою альдегiдам дається закiнчення "аль", кетонам "он". Нумерацiю атомiв вуглецю починають з альдегiдної гру-пи, у кетонiв - з боку, ближчого до карбонiлу, вказуючи в назвi його положення цифрою:

| 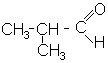
|
| етаналь (МН); оцтовий альдегід; ацетальдегід | 2-метилпропаналь (МН); ізомасляний альдегід; диметилоцтовий альдегід |
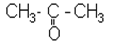
|

|
| пропанон (МН); диметилкетон; ацетон | 3-метилбутанон-2 (МН); метилізопропілкетон |
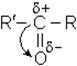
Альдегiди i кетони - сильно полярнi сполуки, тому що в карбонiльнiй групi бiльш негативний кисень вiдтягує до себе електрон, який утворює подвiйний зв'язок С=О (слід зауважити, що більш рухливi p-електрони):

| 
|
Кетони менш реакцiйноздатнi, тому що алкiльнi радикали, проявляючи електровiдштовхувальну дiю (позитивний iндукцiйний ефект +І), дещо компенсують частковий позитивний заряд (d+) на карбонiльному вуглецi i зменшують тим самим електричний момент диполя групи -СО.
Рiзна реакцiйна активнiсть альдегiдiв i кетонiв найдужче проявляється щодо окислювачiв: альдегiди легко окиснюються при дiї оксиду срiбла i гiдроксиду мiдi (II), кетони окиснюються тiльки сильними окислювачами, такими, як перманганат калiю, хромова кислота та iншi, при нагрiваннi. Для альдегiдiв i кетонiв характернi реакцiї нуклеофiльного приєднання по карбонiльнiй групi. Продукти приєднання в рядi випадкiв вiдщеплюють воду, тому реакцiя виглядає як реакцiя замiщення.
Дослiд 11.1. Отримання ацетальдегіду із ацетилену (за реакцією М.Г. Кучерова)
| Реактиви і матеріали: | карбід кальцію, оксид ртуті (ІІ), сульфатна кислота (d=1,84 г/см3). |
| Обладнання: | лійка з відтягнутим кінцем, газовідвідна трубка з відтягнутим кінцем. |
Ацетилен отримують дією води на карбід кальцію.
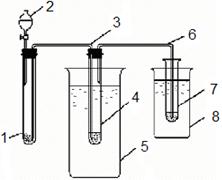
|
| Рис. 11.1. Отримання ацетальдегіду: 1 - пробірка з CaC2; 2 - крапельна лійка; 3 та 6 - газовідвідні трубки; 4 - „реактор”; 5 - склянка з гарячою водою; 7 - мікропробірка; 8 - склянка з охолодженою сумішшю |
У пробірку 1 (рис.11.1) або маленьку колбочку вміщують декілька маленьких шматочків карбіду кальцію та закривають її пробкою з двома отворами, в один з яких вставлена крапельна лійка 2, а в інший - вигнута газовідвідна трубка 3 з відтягнутим кінцем для підводу ацетилену в “реактор” 4. “Реактор” - пробірку з газовідвідною трубкою 6 - також закривають пробкою, через яку майже до днища проходить трубка 3, яка підводить ацетилен. Леткі продукти реакції виходять з “реактора” по відвідній трубці 6 в маленьку пробірку 7, яку охолоджують водою із снігом.
В “реактор” вміщують 0,1 г оксиду ртуті, 2 мл води і 1 мл сульфатної кислоти. Розігріту суміш збовтують, при цьому більша частина ртуті розчиняється з утворенням - сульфату ртуті:
HgO + H2SO2 ® Hg SO4 + H2O
Після розчинення оксиду ртуті “реактор” із сумішшю закривають пробкою з трубкою, яка підводить ацетилен, та вміщують в водяну баню або склянку 5 із гарячою водою (температура близько 80-90°С підтримується протягом всього досліду).
У пробірку (колбочку) з карбідом повільно, краплями, додають із крапельної лійки воду. Створюється потік газоподібного ацетилену, інтенсивність виділення якого повинна бути такою, щоб можна було рахувати пухирці газу, що проходить через “реактор”. Утворений ацетилен, який утворився, проходячи в реакційній пробірці через розчин сірчанокислої ртуті (каталізатор), приєднує воду з утворенням отцтового альдегіду. Через 8-10 хв припиняють пропускання ацетилену та розбирають прилад. Рідина в приймачі має характерний запах оцтового альдегіду.
Хімізм процесу:

Перевіряють утворення оцтового альдегіду кольоровою реакцією з фуксинсірчистою кислотою.
Реакція гідратації ацетилену та його гомологів за потрійними зв’язками в присутності солей оксиду ртуті відкрита М.Г. Кучеровим у 1881 р. Утворена проміжна сполука - вініловий спирт належить до ненасичених спиртів, в яких гідроксильна група розташована при карбоні з подвійним зв’язком. Такі сполуки нестійкі (правило Ельтекова) та у вільному стані не існують. Нестійкість сполук з гідроксилом при подвійному зв’язку пояснюється тим, що вільні електронні пари оксигену вступають у спряження з p - електронами подвійного зв’язку:
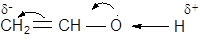
Атом гідрогену гідроксильної групи, набуваючи підвищеного позитивного заряду, легко відкривається у вигляді протона, який приєднується до атома карбону CH2 - групи, що має надлишок електронної густини.
У результаті реакції утворюється сполука з карбонільною групою, а із ацетилену при гідратації оцтовий альдегід  .
.