Двоосновнi кислоти та їхні похiднi
| 
| 
|
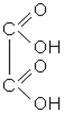
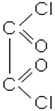
| етандіова кислота; щавлева кислота | хлористий оксаліл | диметилоксалат; диметиловий ефір щавлевої кислоти |
Карбоксильна група - приклад взаємного впливу атомiв у молекулi. Карбонiльна група -С=О , яка в нiй мiститься, вже не має своїх специфiчних властивостей, тому що другий кiнець притягує до себе електрони вiд кисню гiдроксильної групи. Кисень гiдроксилу менш мiцно утримує атом водню i, таким чином, стає можливою дисоцiацiя, характерна для розчинiв карбонових кислот:
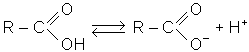
Такий запис неточний, бо в утвореному карбоксиланiонi негативний заряд належить в однаковiй мiрi обом атомам кисню, i його структура записується так:
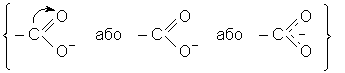
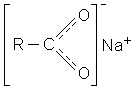
Структура солей карбонових кислот може бути зображена так:
Для IЧ-спектрiв карбонових кислот характерна сильна смуга в областi 1700 см-1 (валентнi коливання С=О) i 2500-3000 см-1 (валентнi коливання О-Н). В складних ефiрах остання вiдсутня, але є двi сильнi смуги при 1050-1300 см-1 (валентнi коливання С-О).