Дослiд 12.4. Взаємодiя з солями
| Реактиви та матеріали: | оцтова кислота (0,1Н розчин), карбонат натрiю (сухий), баритова вода |
| Обладнання: | пробiрки, газовiдвiдна трубка, лучина |
У пробiрку наливають 2-3 краплi розчину оцтової кислоти i додають кiлька крупинок карбонату натрiю. Пробiрку закривають пробкою з газовiдвiдною трубкою, до отвору якої пiдносять запалену лучину. Лучина гасне. Потiм газовiдвiдну трубку занурюють у пробiрку з баритовою водою, вода каламутнiє вiд вуглекислого газу.
Хiмiзм процесу:
2CH3COOH + Na2CO3 ® 2CH3COONa + CO2 + H2O
ацетат натрiю
Карбоновi кислоти у водному розчинi дисоцiюють з утворенням карбоксилат-анiона i протона:
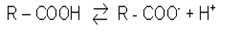
карбонова кислота
Протон Н+ в карбоксильнiй групi вiдщеплюється легше, нiж у спиртах (вплив полярної карбонiльної групи). Утворення карбоксилат-анiона є причиною збiльшення кислотностi карбонових кислот порiвняно зi спиртами. На легкiсть вiдщеплення протона впливає також радикал, пов'язаний з карбоксильною групою. Тому карбоновi кислоти дають характерне забарвлення з iндикаторами, проводять електричний струм, тобто є електролiтами. Карбоновi кислоти порiвняно з неорганiчними - слабкi кислоти (Кдис.~ 10-5).