Дослiд 12.11. Отримання оцтовоетилового ефiру
| Реактиви та матеріали: | ацетат натрiю (порошок), етиловий спирт, сiрчана кислота (d = 1,84 г/см3) |
| Обладнання: | пробірки |
У суху пробiрку насипають трохи порошку зневодненого ацетату натрiю (висота шару 1-1,5 мм) i 3 краплi етилового спирту. Додають 2 краплi концентрованої сульфатної кислоти i обережно нагрiвають над полум'ям пальника. Незабаром з'являється характерний запах оцтовоетилового ефiру.
Важливий спосiб утворення складних ефiрiв - взаємодiя карбонових кислот зi спиртами (реакцiя етерифiкацiї). В ролi каталiзаторiв використовують концентровану H2SO4.
Хiмiзм процесу:
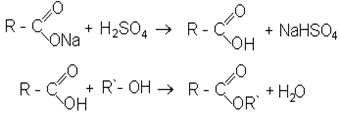
CH3COOH + C2H5OH ® CH3COOC2H5 + H2O
Реакцiя починається з приєднання протона, який утворюється при дисоцiацiї мiнеральних кислот, до карбонiльного атома кисню, який має частково негативний заряд:
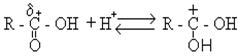
Внаслiдок цього збiльшується позитивний заряд на атомi вуглецю карбоксильної групи, що робить її бiльш здатною до приєднання нуклеофiльного реагента - спирту (за рахунок цього заряду здiйснюється взаємодiя з вiльною електронною парою атома кисню спирту):
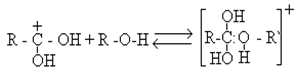
Промiжний комплекс стабiлiзується шляхом вiдщеплення води i протона:
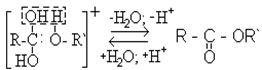
Оцтовоетиловий ефiр використовується як органiчний розчинник.