Енергія йонізації
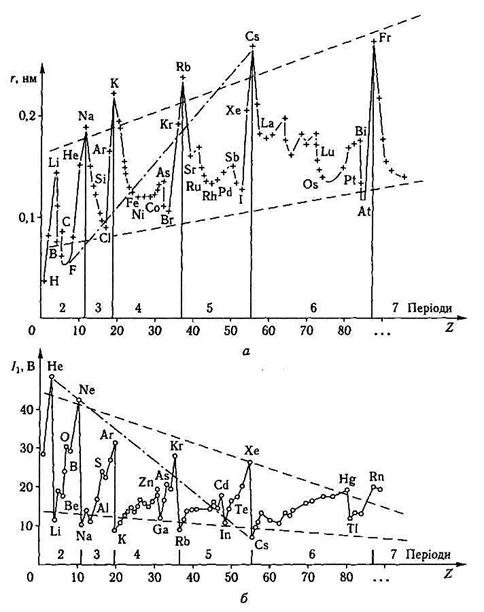
Енергія йонізації (І, кДж/моль; еВ) — мінімальна енергія, потрібна для відщеплення найслабкіше зв'язаного електрона від незбудженого атома: R0 —> R+ +e, I1> 0, де R0 — символ будь-якого елемента, R+ — символ його йона. Потенціал (і енергія) йонізації є складною функцією деяких характеристик атома: заряду ядра, радіуса атома, конфігурації валентних електронних оболонок. Періодичність зміни величини I1 елементів залежно від їх порядкових номерів подано на рис. 3.4, б.
Аналізуючи данні рис.3.4,б, можна зробити відповідні висновки.
• У групах елементів зверху вниз зі зростанням радіусів атомів зменшується сила утримування валентних електронів. Отже, значення енергії йонізації знижується, тобто в цьому напрямі здатність віддавати електрони (окиснюватися) стає енергетично все легшою.
• У періодах елементів зліва направо |—»| у міру зменшення радіусів атомів і водночас зростання ступеня заповнення електронами (зокрема, парами електронів) валентних рівнів значення I1 зростають відповідно. Тобто в цьому напрямі відщеплення електронів атомами енергетично утруднюється.
|
Рис.3.4. Закономірності зміни радіусів r атомів елементів (а) і потенціалів їх іонізації (б).
• Враховуючи характер зміни величин I1 у групах і періодах, треба за
значити, що зліва в системі елементів, і особливо в її нижній частині,знаходяться найактивніші метали-відновники, здатні енергетично легко окиснюватися. Тобто, енергія іонізації може бути кількісною мірою відновлювальної здатності елемента, його “металічності”.