Теплота нейтралізації.
Теплота нейтралізації - тепловий ефект, який спостерігається при нейтралізації одного моль еквівалента кислоти одним моль еквівалента гідроксиду в розведених водних розчинах.
При взаємодії 1моль еквівалента сильної кислоти з 1моль еквівалента сильного гідроксиду в розведених водних розчинах виділяється майже однакова кількість теплоти
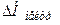 = -55,9 кДж/моль (при 298 К).
= -55,9 кДж/моль (при 298 К).
Розглянемо для прикладу реакцію нейтралізації сильної кислоти сильною основою (лугом):
НС1 + NaOH = NaC I + Н2О,
або в іонній формі:
Н+ + Сl-+ Na+ + ОН-= Na+ + Сl-+ Н2О.
Після скорочення одержимо:
Н+ + ОН-= Н2О; 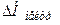 = -55,9 кДж/моль.
= -55,9 кДж/моль.
Сталість теплот нейтралізації пов'язана з тим, що при взаємодії будь-якої сильної кислоти з будь-якою сильною основою, повністю дисоційованими у водних розчинах, у всіх випадках протікає однакова реакція: з іонів Н+ кислоти і іонів ОН-гідроксиду утворюються молекули води. Зрозуміло, що однаковим реакціям відповідає й однаковий тепловий ефект.
Нейтралізація слабких кислот сильними основами або сильних кислот слабкими основами супроводжується одночасно дисоціацією слабкого електроліту. При цьому виділяється або поглинається теплота дисоціації  , яка залежить від кількості теплоти, що поглинається при розпаді молекул слабкого електроліту на іони й теплоти сольватації іонів слабкого електроліту молекулами розчинника. Залежно від того, яка теплота з двох названих буде більшою, теплота дисоціації може бути додатною або від'ємною. Таким чином, теплота нейтралізації слабких кислот і гідроксидів складається із теплоти утворення води з іонів Н+ і ОН-(-55,9 кДж/моль) і теплоти дисоціації слабкого електроліту
, яка залежить від кількості теплоти, що поглинається при розпаді молекул слабкого електроліту на іони й теплоти сольватації іонів слабкого електроліту молекулами розчинника. Залежно від того, яка теплота з двох названих буде більшою, теплота дисоціації може бути додатною або від'ємною. Таким чином, теплота нейтралізації слабких кислот і гідроксидів складається із теплоти утворення води з іонів Н+ і ОН-(-55,9 кДж/моль) і теплоти дисоціації слабкого електроліту  :
:
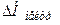 = -55,9 +
= -55,9 +  .
.
Теплоємність.
Загальна теплоємність системи — це кількість теплоти, яка потрібна для підвищення температури системи на один градус. Оскільки вона є величиною екстенсивною, то більш зручно користуватися теплоємністю, віднесеною до одиниці кількості речовини. В залежності від цього розрізняють питому (на 1 г чи 1 кг маси речовини) та мольну (на 1 моль) теплоємності. Їх величини залежать також від умов нагрівання — СV (при V = const) та Ср (р = const). Теплоємність залежить від природи речовини, а також від температури, тому розрізняють середню теплоємність 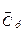 (чи
(чи 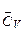 ) у заданому інтервалі температур (від Т1 до Т2) та істинну теплоємність Ср (або СV) при заданій температурі Т. Середня теплоємність
) у заданому інтервалі температур (від Т1 до Т2) та істинну теплоємність Ср (або СV) при заданій температурі Т. Середня теплоємність
 ;
; 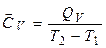 .
.
а істинна теплоємність
 ;
; 
Середня теплоємність наближається до істинної (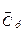 →Cр) при зменшенні температурного інтервалу, коли (Т2— Т1) —> 0. Для 1 моль ідеального газу Cр = CV +R (рівняння Майєра). Робота розширення 1 моль ідеального газу в різних процесах розраховується за формулами:
→Cр) при зменшенні температурного інтервалу, коли (Т2— Т1) —> 0. Для 1 моль ідеального газу Cр = CV +R (рівняння Майєра). Робота розширення 1 моль ідеального газу в різних процесах розраховується за формулами:
| Ізобарний процес (p=const) | Ізохорний процес (V=const) | Ізотермічний процес (T=const) | Адіабатичний процес (δQ=0) |
| Ap=p(V2 - V1) pV=RT Wp=R(T2 - T1) | dV=0 AV=0 | AT= RT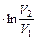 ; AT= RT ; AT= RT
| δA=-dU; CV=dU/dT; dU= CV∙dT; δAQ=- CV∙dT; AQ= CV∙(T1 - T2); |
Температурну залежність Cр звичайно представляють у вигляді емпіричних рівнянь типу
Cр = а +bТ + cT 2 ; Cр = а +bТ + c′ T -2
та інших. У довідкових таблицях наводяться значення коефіцієнтів a, b, c, c′… та інтервал температур, для якого виправдовуються ці залежності.
Залежність теплового ефекту хімічних реакцій від температури описується рівнянням К.Кірхгофа в диференціальній
(d∆Hp/dT)p = ∆Cp та інтегральній  формах.
формах.