Напрям перебігу хімічних процесів.
Другий закон термодинаміки показує напрямок переходу теплоти (енергії) від однієї системи до іншої.
Згідно з Клаузісом теплота завжди переходить від більш нагрітого тіла до менш нагрітого.
Другий закон термодинаміки можна сформулювати ще й так: в ізольованих системах самовільно проходять процеси, що супроводжуються збільшенням ентропії.
Ентропія S – це функція стану системи. Вона характеризує міру невпорядкованості стану системи.
Австрійський фізик Л. Больцман встановив зв'язок між ентропією та ймовірністю стану системи (статистичне формулювання другого закону термодинаміки): S = k In W,
де k - стала Больцмана, яка дорівнює відношенню газової сталої R до сталої Авогадро NA, W - термодинамічна ймовірність.
Отже, ентропія пропорційна термодинамічній ймовірності системи, чим більшою кількістю мікрочастинок представлена дана система, тим більше варіантів їх розподілу, за яких може бути досягнутий даний макростан і тим більше значення ентропії.
Таким чином, ентропія характеризує ту частину енергії, яка не перетворюється в роботу.
Невпорядкованість системи поєднана з хаотичним рухом молекул, атомів та інших дискретних частинок системи. Для газів ентропія завжди більша, ніж для рідин, тому що останні характеризуються більшою впорядкованістю частинок, ніж гази. У свою чергу ентропія твердих тіл менша від ентропії рідини, тому що тверді тіла мають більш упорядковану структуру, ніж рідина, тобто
Sгазу>Sрідини >Sтвердого тіла
Таким чином, при конденсації і кристалізації ентропія речовин зменшується. Навпаки, ентропія зростає при перетворенні твердих речовин у рідину, рідин у газ, а також при розчиненні. В той самий час ентропія зменшується при розчиненні газів у рідинах.
Отже перехід системи з більш упорядкованого в менш упорядкований стан супроводжується збільшенням ентропії. Чим більша ентропія, тим більш невпорядкована система. Рівноважний стан характеризується максимальною невпорядкованістю і найбільшим значенням ентропії.
Приклад. Для наведених нижче систем визначити якісно, як буде змінюватися ентропія при проходженні у них реакцій (Т=const).
1)2КСlO3=2KCl+3O2(г) ; 2) C+O2(г)=CO2(г) ; 3) 2H2(г)+O2(г)=2H2O.
Розв’язання. У першому випадку ентропія зростає, тому що збільшується об’єм системи за рахунок виділення газу – кисню.
Третій закон термодинаміки – закон про абсолютне значення ентропії. Він формулюється так: ентропія будь-якої індивідуальної бездефектної кристалічної речовини (ідеального кристалу) при абсолютному нулю дорівнює нулю.
Визначені на підставі цього закону ентропії хімічних речовин за стандартних умов (298 К, р=101,3 кПа) зведені в таблиці термодинамічних величин і позначені 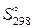 .
.
Зміна ентропії DSº для перебігу хімічної реакції розраховується за тим самим принципом, що й зміна ентальпії хімічної реакції, тобто зміна ентропії реакції дорівнює різниці сум ентропій усіх продуктів реакції і сум ентропій усіх вихідних речовин. Так, для реакції(5.3)
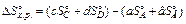 (5.5)
(5.5)
Приклад. За даними термодинамічних величин визначити зміну ентропії системи, в якій проходить така хімічна реакція:
Н2(г)+1/2О2(г)=Н2О(рід)
Розв’язання. Із таблиць термодинамічних величин знаходимо:
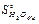 =70,1Дж/(моль·К);
=70,1Дж/(моль·К); 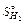 =130,5 Дж/(моль·К);
=130,5 Дж/(моль·К); 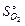 =205 Дж/(моль·К);
=205 Дж/(моль·К); 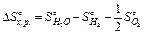 =70,1-130,5-102,5=-161,9 Дж/(моль·К).
=70,1-130,5-102,5=-161,9 Дж/(моль·К).
В ізольованій системі можливе проходження тільки таких процесів, які супроводжуються збільшенням ентропії.
В неізольованих системах крім ентропійного необхідно враховувати і ентальпійний чинник. Для визначення напрямку перебігу хімічної реакції впроваджені термодинамічні величини, що називаються енергією Гіббса (за P і T = const), позначається G; або енергією Гельмгольця (за V і T=const), позначається F. Зміна енергії Гіббса визначається за формулою:
ΔG=ΔH-TΔS,
де ΔH, ΔS, - зміна відповідно ентальпії і ентропії реакції.
Якщо ΔG<0, то реакція може самовільно проходити в прямому напрямку. Якщо ΔG>0, перебіг прямої реакції неможливий. При ΔG=0 система перебуває в стані хімічної рівноваги.
Реакції горіння та інші, в яких ΔН<0 і ΔS>0, можливі без будь-яких обмежень. Екзотермічні реакції ΔН<0, що проходять із зменшенням ентропії ΔS<0, можливі при досить низьких температурах, для яких ТΔS менше за ΔН за абсолютною величиною.
Отже, за низьких температур самочинно можуть відбуватися екзотермічні реакції, а за високих - реакції, що супроводжуються збільшенням ентропії. За проміжних температур на знак і величину ΔG одночасно впливають як ентальпійні, так і ентропійні фактори (див. табл.).
| Ентальпійний чинник | Ентропійний чинник | Зміна енергії Гіббса | Температура | Процес |
| ΔН<0 | ΔS >0 | для кожного значення ΔН і ΔS ΔG<0 | довільна | самочинний – відбувається внаслідок зміни ентропії та ентальпії |
| ΔН<0 | ΔS <0 | ΔН >TΔS ;ΔG <0 ΔG >0 | низька висока | самочинний - зумовлений виключно зміною ентальпії; не самочинний |
| ΔН>0 | ΔS >0 | ΔG >0 ΔН <TΔS ΔG<0 | низька висока | не самочинний самочинний - зумовлений виключно зміною ентропії |
| ΔН>0 | ΔS <0 | ΔG >0 | довільна | не самочинний |