Задачі і вправи для самостійної роботи
1. Стандартна теплота утворення рідкої води становить — 286 кДж/моль. Записати термохімічні рівняння цієї реакції з використанням теплового ефекту та ентальпії. Поглинається чи виділяється в реакції теплота? Чому дорівнює молярна теплота згоряння газуватого водню?
2.Обчислити стандартну ентальпію утворення бензолу, якщо теплота його згоряння становить 3169 кДж/моль, а ентальпія утворення вуглекислого газу та водяної пари відповідно -393 і -242 кДж/моль.
3. За стандартних умов теплота повного бромування білого фосфору дорівнює 229,1 кДж/моль, а теплота бромування червоного фосфору дорівнює 212,3 кДж/моль. Чому дорівнює теплота перетворення червоного фосфору в білий за стандартних умов?
4. Теплота згоряння ромбічної сірки дорівнює -296,8 кДж/моль. Розрахуйте: а) кількість теплоти, яка виділиться в результаті згоряння 64 г ромбічної сірки; б) об'єм кисню (н.у.), який витратиться в ході горіння сірки, якщо в результаті реакції виділяється 59,36 кДж теплоти.
5. Термохімічне рівняння реакції горіння метану:
СН4+2О2=СО2+2Н2О+878 кДж.
Скільки теплоти виділиться, якщо згорить 4,48 л (н. у.) метану?
6.Відновлення Fе3О4 оксидом карбону протікає за рівнянням
Fе3О4 (к)+СО(г) = 3FеО(к) + СО2(г)
Розрахуйте 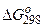 і зробіть висновок про можливість самочинного протікання цієї реакції за стандартних умов. Чому дорівнює
і зробіть висновок про можливість самочинного протікання цієї реакції за стандартних умов. Чому дорівнює 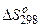 в цьому процесі?
в цьому процесі?
7.Розрахуйте тепловий ефект реакції відновлення оксиду заліза(II) воднем, виходячи з наступних термохімічних рівнянь:
FеО(к)+СO(г)=Fе(к)+СО2(г); ΔH=-13,18 кДж
СО (г) + 1/2О2(г) = СО2 (г); ΔH= -283,0 кДж
H2 (г) + 1/2О2(г) = H2O(г); ΔН= -241,83 кДж
8.Визначте роботу при ізотермічному стисненні одного кіломоля CO2 при Т=298 К від тиску p1= 104 Н/м2 до p2= 105 Н/м2.
9.Використовуючи прийом алгебраїчного додавання термохімічних рівнянь, визначити ΔНо утворення етилену за наступними експериментальними даними:
С2Н4 + 3О2 = 2СО2 + 2Н2О; ΔН1о = -1323,0 кДж;
С + О2 = СО2 ; ΔН2о = -392,5 кДж;
Н2 + 1/2О2 = 2Н2О; ΔН3о = -241,5 кДж.
10.Записати аналітичний вираз залежності теплового ефекту реакції:
СН3ОН(г) + 3/2О2 =СО2 + 2Н2О(г)
від температури та визначити ΔН цієї реакції при 700 К, використовуючи наступні дані:
| Речовина | ΔНо·106,Дж/кмоль | Сp·10-3,Дж/(кмоль·К) |
| СО2 | -393,5 | 31,1 |
| Н2О | -241,8 | 33,6 |
| СН3ОН(г) | -201,2 | 43,9 |
| О2 | 29,4 |