Розділ хімії, який вивчає перебіг хімічних процесів за певний час, має назву хімічної кінетики.
Дослідження кінетики хімічних процесів має не тільки теоретичний, а й практичний інтерес. Необхідність врахування кінетичного фактора при розгляданні хімічних реакцій можна побачити на прикладі взаємодії кисню і водню. Незважаючи на те що реакція: 2Н2(г) + О2(г) = 2Н2О(г), 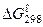 = - 456,4 кДж
= - 456,4 кДж
характеризується значним зменшенням ізобарного потенціалу, тобто є можливість самовільного перебігу процесу, за звичайних умов водень і кисень між собою не реагують, а їхня суміш може зберігатись будь-який час. При наявності каталізатора або при нагріванні до 700о С ( = — 495,3 кДж) суміш реагує дуже швидко або навіть з вибухом. В обох випадках ізобарний потенціал системи майже однаковий, а кінетичні особливості різні.
= — 495,3 кДж) суміш реагує дуже швидко або навіть з вибухом. В обох випадках ізобарний потенціал системи майже однаковий, а кінетичні особливості різні.
Розглядаючи питання хімічної кінетики, треба розрізняти гомогенні і гетерогенні реакції. Хімічні реакції, які відбуваються в гомогенній системі, називаються гомогенними. Гомогенна система складається лише з однієї фази (газова фаза, рідкий розчин). Гетерогенні реакції відбуваються в неоднорідному середовищі між речовинами, які перебувають у різних фазах (газ і рідина, кристал і рідина тощо). Якщо гомогенні реакції відбуваються у всьому об'ємі системи, то перебіг гетерогенних реакцій можливий лише на поверхні поділу фаз.
Швидкість хімічних реакцій характеризує інтенсивність хімічного процесу, тобто число елементарних актів взаємодії або розкладання за одиницю часу в одиниці об'єму (для гомогенних реакцій)абона одиницю поверхні поділу фаз (для гетерогенних реакцій).