Кислоти
За теорією електролітичної дисоціації Арреніуса кислоти - це сполуки, що складаються з кислотного залишку і йонів гідрогену, здатних заміщуватись на метал (у розчині дисоціюють з утворенням катіонів тільки гідрогену). Кількість таких йонів гідрогену визначаєосновність кислоти: НС1, HNO3 – одноосновні, H2SO4, H2CO3 - двоосновні, Н3РО4- триосновна і т.д. Кислоти, до складу яких входять атоми оксигену, називаютькисневими, якщо атоми оксигену відсутні- безкисневими.
Назви безкисневих кислот походять від назв елементів, що їх утворюють, або від міжнародних назв кислотних залишків з закінченням-на: НС1 - хлороводнева або хлоридна (тривіальна назва - соляна), H2S - сірководнева або сульфідна, HF - флуороводнева або фторидна (тривіальна назва - плавикова).
Згідно з правилами IUPAC назви кисневих кислот також походять під міжнародних назв відповідних кислотних залишків з додаванням закінчення -на: НС1О4 - хлоратна; H2SO4 -сульфатна; H2SO3 -сульфітна; HNO3, -нітратна; HNO2 -нітритна і т.д. Однак в хімічній літературі та побуті на сьогоднішній день ще досить часто зустрічаються загальновживані раніше назви кисневих кислот. Основу цих назв складають найменування центрального атома - елемента, навкруг якого розміщені атоми оксигену і гідрогену. Причому, якщо ступінь окиснення цього елемента відповідає номеру групи, в якій він знаходиться, назва кислоти має закінчення -на (-ва), якщо ступінь окиснення менший від номера групи, закінчення -иста.
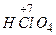 - хлорна
- хлорна 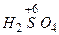 - сірчана
- сірчана 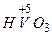 - ванадієва
- ванадієва
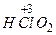 - хлориста
- хлориста 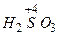 - сірчиста
- сірчиста 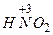 - азотиста
- азотиста
Але є кислоти, утворені одним і тим же елементом з однаковим ступенем окиснення, але до їх складу входить різна кількість атомів гідрогену і оксигену. Тоді там, де цих атомів менше, до назви кислоти додають префікс "мета", а де найбільше - "орто": H2SiO3 - метасилікатна (метакремнієва), H4SiO4 - ортосилікатна (ортокремнієва).
В графічних формулах безкисневих кислот атоми гідрогену зв'язані безпосередньо з атомом елемента, який утворив кислоту: Н-С1, H-S-H, H-F, а в кисневих кислотах атоми гідрогену, що визначають основність кислоти, сполучають з атомами оксигену, які в свою чергу з'єднують з центральним атомом:
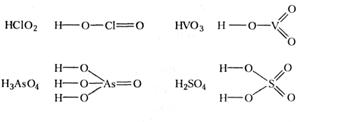
Хімічні властивості кислот зумовлені йонами гідрогену (точніше - гідроксонію Н3О+), що утворюються при розчиненні й дисоціації кислот у воді. Ці ж йони зумовлюють кислий смак розчину і забарвлення індикатора в характерний колір. Оскільки атоми гідрогену зв'язані з кислотним залишком досить міцним ковалентним зв'язком, на йони дисоціюють не всі молекули кислоти, а процес дисоціації - оборотний.
При взаємодії кислот з основами та оксидами (основними й амфотерними) обов'язковими продуктами реакцій є сіль і вода. Кислоти взаємодіють також з солями. Такі реакції протікають з утворенням малорозчинних або летких продуктів, а також коли більш сильна кислота витискує більш слабку:
H2S + Pb(NO3)2 = 2HNO3 + PbS↓
2HNO3 + СаСО3 = Са(NO3)2 + Н2О+СО2↑
HCl + CH3COONa= NaCl+CH3COOH
Важливою властивістю кислот є їх взаємодія з металами. Характер взаємодії залежить від активності металу і температури, а для деяких кислот – визначається їх особливою окисною функцією. Активні метали, що в ряді стандартних електродних потенціалів стоять до водню, витискують його з кислот:
2A1 + 3H2S04 = A12(S04)3 + 3H2↑
Zn + 2HCl = ZnCl2 + H2↑
Малоактивні ж метали, що стоять після водню, з кислотами, як правило, не взаємодіють за винятком азотної та концентрованої сірчаної кислот, які реагують як з активними, так і деякими неактивними металами, але виділяється при цьому не водень, а продукти відновлення нітрогену(азоту) чи сульфуру(сірки):
Cu (Zn та ін.) + 4HNO3 = Сu(NО3)2 + 2NО2 + 2Н2О
Си + 2H2SO4(к.) = CuSO4 + S02 + 2Н2О
Більшість кисневих кислот одержують взаємодією кислотних оксидів з водою. Кислоти, ангідриди яких з водою не реагують, добувають із відповідних солей за реакціями обміну:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
(NH4)2MoQ4 + 2HNO3 = 2NH4N03 + H2MoO4↓
Так можна одержувати й інші кислоти, однак слід пам'ятати, що такі реакції протікають тільки тоді, коли виділяються газоподібні, малорозчинні чи малодисоційовані речовини.