Коагуляція.
Виробничі стічні води дуже часто містять високодисперсні нерозчинні домішки, видалення яких механічними методами дуже проблематично. У таких випадках може бути ефективна коагуляція. Коагуляцію стічних вод роблять або звичайними реагентами, що утворять у воді пластивців гідроксидов (солі алюмінію, заліза) чи реагентами, що змінюють активну реакцію середовища (кислоти, лугу) і зухвалими тим самим коагуляцію домішок (солей заліза, білкових речовин і т.д.). У деяких випадках додані реагенти вступають у реакцію з одними домішками, що сприяє коагуляції інших. Ви-бор того чи іншого реагенту для коагуляції виробляється на підставі вивчення фізико-хімічного складу стічних вод і експериментальної перевірки дії різних реагентів.
Солі алюмінію можуть застосовуватися для коагуляції стічних вод, що мають рН 4-8. Посколь-ку дози коагулянту можуть бути високими (іноді до 1г/л і вище) стічна рідина повинна володіти достатнім лужним резервом для нейтралізації кислоти, що утвориться при гідролізі:що утворився
Al2(SO4)3 + 6H2O = 2Al(OH)3 + 3H2SO4.
Якщо лужного резерву недостатньо, у стічну воду необхідно додавати лужні реагенти для нейтралізації цієї кислоти - вапно, соду, їдкий натр.
Солі алюмінію використовують головним чином у виді сульфату алюмінію, але може застосовуватися також алюмінат натрію NaAl2, що доцільно використовувати для кислих стічних вод чи самостійно в суміші із сульфатом, хлоридом, алюмокаліевыми квасцами, оксіхлоридом алюмінію:
Al2(SO4)3 + 6NaAl2 + 12H2O 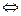 8Al(OH)3 + 3Na2SO4.
8Al(OH)3 + 3Na2SO4.
Солі заліза застосовують у виді чи сульфату хлориду заліза. Сульфат заліза FeSO4.7H2O містить двовалентне залізо, гідроксід якого нерозчинимо при рН>9. При менших значеннях рН стічних вод необхідно створити умови для окислювання двовалентного заліза в тривалентне, наприклад, з використанням аерації.
4Fe(OH)2 + O2 + 2H2O 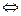 Fe(OH)3.
Fe(OH)3.
Створений при цьому гідроксід тривалентного заліза починає осаджуватися вже при рН>3. Окислювання двовалентного заліза протікає найбільше ефективно при рН 7,5-8. У слабокіслому середовищу іноді більш зручним може виявитися використання хлориду заліза FeCl3.6H2O, однак його вартість вище чим вартість сульфату заліза. Для зниження витрат на коагуляцію стічних вод можуть бути використані стоки, що містять солі заліза, зокрема стоки від травлення металів.
Застосування солей заліза для коагуляції особливо ефективно в тих випадках, коли з їхньою допомогою можна вирішувати й інші технологічні задачі, такі як відновлення шестивалентного хрому до тривалентного, переклад розчинних сульфідів у нерозчинний сульфід заліза. Разом з тим при застосуванні солей заліза необхідно пам'ятати про те, що вони можуть викликати фарбування стічних вод за рахунок утворення розчинних пофарбованих комплексів з деякими органічними речовинами.
Для коагуляції сильнолужних стічних вод застосовують солі магнію - MgCl2.6H2O, MgSO4.7H2O. Гідроксід магнію утвориться при рн стічних вод більш 11. Можна використовувати також карбонат магнію разом з вапном при цьому утворяться два нерозчинних з'єднання - гідроксід магнію і карбонат кальцію.
У спеціальних випадках використовують чи карбонат хлорид кальцію, фосфати, чи сульфат оксіхлорід цирконію й інші.
Технологічні схеми очищення стічних вод і використанням коагуляції включають реагентне господарство для готування і дозування реагентів, змішувачі, камери реакцій і спорудження для виділення нерозчинних домішок шляхом відстоювання, фільтрування, флотації і т.д.
ЛЕКЦІЯ 18
11. ХІМІЧНІ МЕТОДИ ОЧИЩЕННЯ.