Нейтралізація.
Виробничі стічні води багатьох галузей промисловості можуть містити кислоти і луги. У більшості кислих стічних вод, крім того, міститися солі важких металів. З метою попередження корозії матеріалів каналізаційних споруджень, порушення біологічних процесів при очищенні стічних вод і у водоймах, а також для осадження зі стічних вод важких металів стічні води піддають нейтралізації.
При спуску стічних вод у чи водойму в міську каналізаційну мережу практично нейтральними варто вважати стічні води з рН = 6,5-8,5. Отже, піддавати нейтралізації випливають стічні води з рН менш 6,5 і більш 8,5 , при цьому враховуються лужний резерв міських стічних чи вод води водойми, куди виробляється скидання стічних вод. Велику небезпеку представляють кислі стічні води, що до того ж зустрічаються значно частіше, ніж лужні. Якщо виробничі стічні води використовуються в оборотних циклах водопостачання, то вимоги до активної реакції можуть бути значно вище.
Найбільше часто стічні води забруднені мінеральними кислотами: H2SO4, HNO3 , HCl, а також їхніми сумішами. Значно рідше в стічних водах зустрічаються HNO2 , H3PO4 , H2SO3 і ін., а також органічні кислоти: оцтова СН3СООН, пікринова НІС6Н2(NO2)3, саліцилова З6Н4(ВІН)2 і інші.
Для нейтралізації застосовують реагентний і фільтраційний способи.
Реагентный спосіб полягає в додаванні в стічні води нейтралізуючого реагенту. Для нейтралізації кислих стоків використовуються негашене вапно СаО, гашене вапно Са(ВІН)2, кальцинована сода Na2CO3, каустична сода NaOH, аміак NH3OH.
Для нейтралізації мінеральних кислот застосовують будь-як лужний реагент, але найчастіше вапно у виді пушонки чи вапняного молока, а також карбонати кальцію і магнію у виді суспензії. Ці реагенти значно дешеві і загальнодоступні, але мають ряд недоліків: обов'язковий пристрій усереджувач, труднисть регулювання дози реагенту по рН і складність реагентного господарства. Швидкість реакції між розчинами кислоти і твердих часток реагенту відносно невелика і залежить від розмірів часток і розчинності продуктів реакції, що утворяться. Тому активна реакція встановлюється не відразу, а після деякого часу після додавання реагенту (10-15хв). При нейтралізації стічних вод, що містять сірчану кислоту, у залежності від застосовуваного реагенту реакції протікають по рівняннях:
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O.
H2SO4 + CaCO3 = CaSO4 + H2O + CO2.
Сульфат кальцію, що утвориться в результаті нейтралізації, кристалізується у виді СаSо4.2H2O, якщо його концентрація перевищує межу розчинності. Однак варто пам'ятати при цьому можливо утворення пересиченого розчину, особливо в присутності органічних речовин. З цього розчину гіпс кристалізується в плині тривалого часу (іноді до декількох доби), що приводить до заростання трубопроводів і апаратури. Для зменшення коефіцієнта пересичення і збільшення швидкості кристалізації використовується метод рециркуляції осаду сульфату, що утвориться при нейтралізації, кальцію, при цьому тривалість перемішування повинна бути не менш 20-30хв. Для зменшення заростання трубопроводів застосовують методи промивання, збільшують швидкість транспортування стічних вод, а також заміняють металеві трубопроводи на пластмасові.
Витрата реагенту на нейтралізацію розраховується виходячи з дози реагенту і витрати стічних вод:
G = 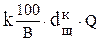 , кг/доба, де
, кг/доба, де
k - коефіцієнт запасу витрати реагенту, для вапняного молока 1,1; для вапняного тесту і сухого вапна 1,5.
В - кількість активної частини в товарному продукті.
Q - витрата стічних вод, м3/доба.
 - доза реагенту по активному продукті, кг/м3.
- доза реагенту по активному продукті, кг/м3.
Доза реагенту розраховується по стехиометричному рівнянню по концентрації нейтрализуючей кислоти. Якщо в кислих стічних водах міститися солі важких металів, то дозу реагенту варто збільшити на реакцію утворення нерозчинних з'єднань цих металів, тобто
G = 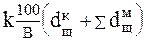 , де
, де
 - доза реагенту для перекладу металів у нерозчинні з'єднання.
- доза реагенту для перекладу металів у нерозчинні з'єднання.
Наприклад, при нейтралізації гашеним вапном стічних вод, що містять 1,5 кг/м3 сарною кислоти і 0,5 кг/м3 сульфату заліза відбуваються наступні реакції:
H2SO4 + Са(ВІН)2 = СаSO4 + 2H2O.
98 74
1,5 
FeSO4 + Ca(OH)2 = Fe(OH)2 + CaSO4.
152 74
0,5 
Тоді доза реагенту для нейтралізації кислоти:
 =
= 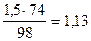 кг/м3.
кг/м3.
Доза реагенту на реакцію із сульфатом заліза:
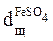 =
= 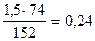 кг/м3.
кг/м3.
Процеси реагентної нейтралізації стічних вод здійснюються в нейтрализаційных установках, основними елементами яких є: піскоуловлювачі, усереджувачі, змішувач стічних вод з реагентом, камери реакції, чи відстійники осветлители, реагентне господарство, пристрої для хімічного контролю за ступенем нейтралізації, спорудження для обезвожи-вания і складування опадів. Реагентне господарство включає склад нейтралізуючого реагенту, розчинні і видаткові баки, дозатори робочих розчинів реагентів.
При наявності на підприємствах кислих і лужних стічних вод може вироблятися їхня взаємна нейтралізація. При цьому необхідно звертати увага на те, щоб при змішуванні цих стічних вод не утворювалися речовини, здатні давати з повітрям пальні чи вибухонебезпечні суміші.
Нейтралізація солянокислих і азотнокислих стічних вод, а також сірчанокислих стічних вод при концентрації сірчаної кислоти не більш 1,5 г/л може здійснюватися фільтраційним способом. Для завантаження фільтрів застосовують такі нейтралізуючі реагенти, як доломить, вапняк, магнезит, крейда, мармур. Крупність фракцій завантаження повинна складати 3-8див, розрахункова швидкість фільтрування 5м/година, тривалість контакту не менш 10хвилин. Застосування таких фільтрів можливо, якщо в результаті нейтралізації не утворяться нерозчинні речовини, здатні забивати пори чи фільтрів покривати поверхня нейтралізуючої завантаження, утрудняючи доступ до неї кислоти. Таким чином, нейтралізація фільтраційним способом може здійснюватися за умови відсутності в кислих стоках розчинених солей металів і якщо концентрація сірчаної кислоти не перевищує 1,5г/л, тому що більш високі концентрації приводять до утворення сульфату кальцію, кількість якого більше його розчинності і він починає випадати в осад. Якщо завантаження виконується з карбонату магнію останні обмеження знімаються, тому що розчинність сульфату магнію досить висока (355г/л по MgSO4.7H2O).
Конструкція вертикального фільтра для нейтралізації стічних вод приведена на мал.36.


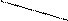

| |

Рис.36. Вертикальний фільтр для нейтралізації стічних вод.
1.Подача кислих стічних вод; 2.Прийомна камера; 3.Завантаження нейтралізуючого реагенту; 4.Підтримуючий шар гравію; 5.Дренаж;6.Випуск нейтралізованих стічних вод.
Висоту шаруючи завантаження визначають по формулі С.А.Вознесенська:
Н = kdn(3+lgb) , де
, де
k і n - емпіричні константи;
d - діаметр зерен завантажувального матеріалу, мм;
b - концентрація кислоти; г-экв/л;
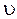 - швидкість фільтрування, м/година.
- швидкість фільтрування, м/година.
Приведене рівняння справедливе для сірчаної кислоти, для інших кислот потрібно експериментальна його перевірка.
Площа фільтрування в мг:
 , де
, де
Q - витрата стічних вод, м3година;
Добова витрата завантажувального матеріалу, т/сут:
M =  , де
, де
з - концентрація кислоти в стічних водах, кг/м3;
m – стехиометричний коефіцієнт, обумовлений по рівнянню реакції;
Q - витрата стічних вод, м3/доба.
Тому що повне використання активної частини завантажувального матеріалу фільтра неможливо, те фактична витрата матеріалу дорівнює:
МФ = 1,5. М.
Тривалість роботи фільтра без перевантаження нейтралізуючого матеріалу визначається по формулі:
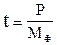 , де
, де
Р - маса матеріалу, що завантажується у фільтр.
Для нейтралізації можуть бути використані також і горизонтальні фільтри.
При проектуванні установок по нейтралізації кислих стічних вод усі резервуари, трубопроводи й устаткування, що стикаються зі стічними водами, варто приймати з кислототривкого чи матеріалу передбачати надійну ізоляцію.
ЛЕКЦІЯ 19