Основные классы неорганических соединений
1. Основные классы неорганических соединений
Взаимосвязь между основными классами неорганических веществ (оксиды, кислоты, основания, соли) можно упрощенно представить в виде схемы:

Химические свойства основных классов неорганических соединений:
| Металл | Основной оксид | Основание | Соль | |
| Неметалл | Fe + S = FeS | — | — | 2NaBr + Cl2 = 2NaCl + Br2 |
| Кислотный оксид | — | CaO + CO2 = CaCO3 | 2NaOH + CO2 = Na2CO3 + H2O | — |
| Кислота | Fe + 2HCl = FeCl2 + H2 | CaO + H2SO4 = CaSO4 + H2O | NaOH + HCl = NaCl + H2O | BaCl2 + H2SO4 = BaSO4↓ + 2HCl |
| Соль | Zn + CuSO4= Cu + ZnSO4 | — | CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 | AgNO3 + NaCl = AgCl↓ + NaNO3 |
1.1. Назовите вещество и укажите класс химических соединений:
1.1.1. Fe(OH)2Cl
1.1.2. K2CrO4
1.1.3. Mg(ClO3)2
1.1.4. NaHS
1.1.5. Al(OH)3
1.1.6. NaH2PO4
1.1.7. NH4OH
1.1.8. Na2Cr2O7
1.1.9. Ba(HSO3)2
1.1.10. Na2SO3
1.1.11. Ba(OH)2
1.1.12. HClO4
1.1.13. (CuOH)2CO3
1.1.14. Ba2P2O7
1.1.15. HMnO4
1.1.16. Al(OH)SO4
1.1.17. Ca(ClO)2
1.1.18. Ca(H2PO4)2
1.1.19. Al(NO3)3
1.1.20. K2ZnO2
1.2. Напишите формулы следующих соединений:
| 1.2.1. Хлорид фосфора (III) 1.2.2. Хромат калия 1.2.3. Гидрофосфат кальция 1.2.4. Гидроксид цинка 1.2.5. Дигидрофосфат калия 1.2.6. Пероксид водорода 1.2.7. Гидрокарбонат натрия 1.2.8. Оксид марганца (IV) 1.2.9. Селеновая кислота 1.2.10. Хлорид аммония | 1.2.11. Нитрат ртути (II) 1.2.12. Сульфат железа (III) 1.2.13. Гидрофосфат железа (II) 1.2.14. Угольная кислота 1.2.15. Бромоводородная кислота 1.2.16. Нитрат хрома (III) 1.2.17. Нитрат меди (II) 1.2.18. Гидроксид железа (III) 1.2.19. Ортофосфорная кислота 1.2.20. Перманганат натрия |
1.3. Составьте уравнение реакции получения следующего соединения и
рассчитайте массы реагентов, необходимых для получения 1 г вещества:
| 1.3.1. BaCrO4 1.3.2. (CuOH)2CO3 1.3.3. Al(OH)SO4 1.3.4. Ba(HSO3)2 1.3.5. NH4HS | 1.3.6.Cr(OH)SO4 1.3.7. Fe(NO3)3 1.3.8. NaHSO3 1.3.9. Ba(H2PO4)2 1.3.10. KClO3 | 1.3.11. MgHPO4 1.3.12. Fe(OH)Cl2 1.3.13. Ca(HSO4)2 1.3.14. NaH2PO4 1.3.15. Na2HPO4 | 1.3.16. Be(ClO4)2 1.3.17. Na4P2O7 1.3.18. LiHSO4 1.3.19. (NH4)2SO4 1.3.20. Al(OH)2NO3 |
1.4. Напишите уравнения соответствующих реакций, учитывая, что другие вещества можно использовать только в качестве катализаторов:
1.4.1. Даны: сульфат никеля, гидроксид натрия, хлор, водород. Получить: хлорид никеля (II), хлорид натрия, оксид никеля (II).
1.4.2. Даны: оксид меди (II), оксид серы (VI), натрий, вода. Получить: серную
кислоту, гидроксид меди (II), медь.
1.4.3. Даны: оксид меди (II), нитрат бария, серная кислота, гидроксид натрия,
вода. Получить: гидроксид меди (II), гидроксид бария, азотную кислоту.
1.4.4. Даны: кислород, натрий, сера, оксид магния, вода, соляная кислота.
Получить: хлорид магния, гидроксид магния, сульфит натрия.
1.4.5. Даны: гидроксид бария, вода, кислород, серная кислота, железо, оксид меди (II). Получить: гидроксид меди (II), сульфат железа (II), гидроксид железа (III).
1.4.6. Даны: карбонат меди (II), оксид азота (IV), вода, натрий. Получить: нитрат меди (II), гидроксид меди (II), карбонат натрия.
1.4.7. Даны: алюминий, кислород, сульфат меди (II), железо, соляная кислота.
Получить: хлорид меди (II), хлорид железа (II), сульфат алюминия.
1.4.8. Даны: хлорид железа (III), барий, вода, соляная кислота. Получить: железо, оксид железа (III), хлорид железа (II).
1.4.9. Даны: кислород, уголь, гидроксид кальция. Получить: оксид кальция,
карбонат кальция, гидрокарбонат кальция.
1.4.10. Даны: оксид серы (IV), вода, кислород, хлорид натрия, нитрат серебра.
Получить: хлорид серебра, серебро, соляную кислоту.
1.4.11. Даны: оксид кальция, уголь, хлорат калия, серная кислота. Получить:
карбонат кальция, оксид углерода (II), хлороводород.
1.4.12. Даны: магний, уголь, кислород, соляная кислота, гидроксид натрия.
Получить: оксид магния, гидроксид магния, карбонат магния.
1.4.13. Даны: железо, сера, вода, кислород, гидроксид натрия. Получить: серную кислоту, сульфат железа (II), гидроксид железа (III).
1.4.14. Даны: оксид меди (II), оксид серы (IV), кислород, натрий, соляная кислота. Получить: гидроксид меди (II), серную кислоту, сульфат меди (II).
1.4.15. Даны: водород, кислород, азот. Получить: азотную кислоту, нитрат
аммония, оксид азота (I).
1.4.16. Даны: хлорид алюминия, натрий, вода. Получить: алюминат натрия,
алюминий, оксид алюминия.
1.4.17. Даны: сульфид аммония, сульфит натрия, водород, хлор. Получить: сероводород, оксид серы (IV), серу.
1.4.18. Даны: гидроксид алюминия, гидроксид калия, фосфор, кислород, вода, оксид серы (IV). Получить: сульфит калия, дигидрофосфат калия, оксид алюминия.
1.4.19. Даны: оксид меди (II), сульфид натрия, соляная кислота, кислород.
Получить: сероводород, сульфат меди (II), сульфид меди (II).
1.4.20. Даны: натрий, кислород, вода, оксид железа (II), соляная кислота.
Получить: гидроксид натрия, хлорид железа (II), хлорид железа (III).
1.5. Изобразите структурные формулы следующих соединений:
| 1.5.1. Пероксид водорода 1.5.2. Борная кислота 1.5.3. Метафосфорная кислота 1.5.4. Серная кислота 1.5.5. Пирофосфорная кислота 1.5.6. Азотная кислота 1.5.7. Хлорноватистая кислота 1.5.8. Циановодородная кислота 1.5.9. Хлорноватая кислота 1.5.10. Ортофосфорная кислота | 1.5.11. Гидроксид меди (II) 1.5.12. Гидразин 1.5.13. Фосфористая кислота 1.5.14. Гидроксиламин 1.5.15. Угольная кислота 1.5.16. Хлорная кислота 1.5.17. Сернистая кислота 1.5.18. Азотистая кислота 1.5.19. Гидроксид кальция 1.5.20. Гидроксид железа (III) |
2. Основные законы химии
Закон Авогадро: равные объемы газов при нормальных условиях содержат одинаковое количество молекул.
Уравнение состояния идеального газа (Менделеева – Клапейрона):
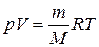 ,
,
где p – давление, Па; V – объем, м3; m – масса, г; M – молярная масса, г/моль;
R = 8,31 Дж/(моль×К) – универсальная газовая постоянная; T – температура, К.
Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 моль атомов водорода или замещают его в соединении.
Эквивалентная масса элемента равна его атомной массе, деленной на его
валентность.
Эквивалентная масса кислоты/основания равна их молярной массе, деленной на его основность/кислотность.
Эквивалентная масса окислителя/восстановителя равна его молярной массе, деленной на число электронов, принимаемых/отдаваемых в ходе реакции.
2.1. Рассчитайте давление в сосуде:
2.1.1. объемом 5 л, содержащем 16 г кислорода и 28 г азота при 0ºС
2.1.2. объемом 20 л, содержащем 28 г этилена и 10 г аргона при 50ºС
2.1.3. объемом 10 л, содержащем 16 г метана и 42 г азота при -10ºС
2.1.4. объемом 20 л, содержащем 16 г кислорода и 28 г азота при 30ºС
2.1.5. объемом 20 л, содержащем 8 г метана и 4 г водорода при 25ºС
2.1.6. объемом 5 л, содержащем 18,25 г хлороводорода и 20,25 г бромоводорода при 80ºС
2.1.7. объемом 5 л, содержащем 1 г водорода и 2 г гелия при 20ºС
2.1.8. объемом 20 л, содержащем 16 г диоксида серы и 7 г азота при 15ºС
2.1.9. объемом 10 л, содержащем 14 г оксида углерода и 44 г диоксида углерода при 0ºС
2.1.10. объемом 50 л, содержащем 24 г метана и 4 г гелия при 0ºС
2.1.11. объемом 20 л, содержащем 8 г водорода и 30 г этана при 80ºС
2.1.12. объемом 20 л, содержащем 2 г гелия и 42 г азота при 20ºС
2.1.13. объемом 20 л, содержащем 8 г кислорода и 22 г диоксида углерода
при 125ºС
2.1.14. объемом 20 л, содержащем 32 г кислорода и 14 г азота при 45ºС
2.1.15. объемом 5 л, содержащем 4 г водорода и 8,5 г аммиака при 50ºС
2.1.16. объемом 10 л, содержащем 10 г аргона и 48 г кислорода при 0ºС
2.1.17. объемом 50 л, содержащем 20 г гелия и 8 г водорода при -100ºС
2.1.18. объемом 50 л, содержащем 17 г фосфина и 6 г водорода при 200ºС
2.1.19. объемом 10 л, содержащем 34 г аммиака и 14 г азота при 50ºС
2.1.20. объемом 10 л, содержащем 51 г аммиака и 7 г азота при 50ºС
2.2. Вычислите эквивалентную массу:
2.2.1. азота в оксидах N2O, NO, NO2
2.2.2. соляной кислоты в реакции 2HCl + Ni = NiCl2 + H2
2.2.3. металла, при сгорании 2 г которого образуется 2,76 г оксида
2.2.4. серы в фторидах SF4 и SF6
2.2.5. железа в оксидах FeO, Fe2O3
2.2.6. фосфорной кислоты в реакции H3PO4 + Mg(OH)2 = MgHPO4 + 2H2O
2.2.7. металла, при сгорании 5 г которого образуется 9,44 г оксида
2.2.8. серы в оксидах SO2 и SO3
2.2.9. мышьяковой кислоты в реакции H3AsO4 + NaOH = NaH2AsO4 + H2O
2.2.10. металла, 2 г которого вытесняют из соляной кислоты 1,85 л водорода (н.у.)
2.2.11. перманганата калия в реакции
2KMnO4 + 2KOH + Na2SO3 = 2K2MnO4 + H2O + Na2SO4
2.2.12. углерода в оксидах CO и CO2
2.2.13. перманганата калия в реакции
2KMnO4 + 3H2SO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
2.2.14. титана в хлоридах TiCl2, TiCl3, TiCl4
2.2.15. перманганата калия в реакции
2KMnO4 + H2O + 3Na2SO3 = 2KOH + 2MnO2 + 3Na2SO4
2.2.16. хрома в оксидах CrO, Cr2O3, CrO3
2.2.17. гидроксида кальция в реакции Ca(OH)2 + 2CO2 = Ca(HCO3)2
2.2.18. основной соли в реакции Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl
2.2.19. основной соли в реакции Fe(OH)2Cl + 2HCl = FeCl3 + 2H2O
2.2.20. сульфита натрия в реакции
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + K2SO4 + Cr2(SO4)3 + 4H2O
2.3. Определите простейшую формулу вещества, если оно содержит
(по массе):
2.3.1. 18,28% лития, 71,09% алюминия и 10,62% водорода
2.3.2. 60,04% калия, 18,45 углерода и 21,51% азота
2.3.3. 72,36% железа и 27,64% кислорода
2.3.4. 1,40% водорода, 19,49% кремния и 79,11% фтора
2.3.5. 44,90% калия, 0,58% водорода, 17,78% фосфора и 36,74% кислорода
2.3.6. 19,15% натрия, 0,84% водорода, 26,74% серы и 53,31% кислорода
2.3.7. 35,00% азота, 5,04% водорода и 59,96% кислорода
2.3.8. 27,41% азота, 9,86% водорода и 62,73% серы
2.3.9. 52,14% углерода, 13,13% водорода и 34,73% кислорода
2.3.10. 57,48% меди, 0,91% водорода, 5,43% углерода и 36,18% кислорода
2.3.11. 69,19% серебра, 10,28% серы и 20,53% кислорода
2.3.12. 17,11% кальция, 0,86% водорода, 27,38% серы и 54,65% кислорода
2.3.13. 3,69% водорода, 37,77% фосфора и 58,54% кислорода
2.3.14. 39,67% калия, 27,87% марганца и 32,46% кислорода
2.3.15. 46,65% азота, 6,71% водорода, 20,00% углерода и 26,64% кислорода
2.3.16. 65,78% цинка, 2,03% водорода и 32,19% кислорода
2.3.17. 31,90% калия, 28,93% хлора и 39,17% кислорода
2.3.18. 26,95% серы, 13,45% кислорода и 59,60% хлора
2.3.19. 36,80% азота, 5,30% водорода, 15,78% углерода и 42,12% серы
2.3.20. 8,46% углерода, 2,13% водорода и 89,41% иода.
2.4. Расставьте стехиометрические коэффициенты в реакциях и рассчитайте, какую массу второго реагента необходимо взять на 1 г первого, чтобы
реакция прошла до конца:
2.4.1. H2O + P2O5 → H3PO4
2.4.2. NaH2PO4 + KOH → NaK2PO4 + H2O
2.4.3. (CuOH)2CO3 + H2SO4 → CuSO4 + CO2 + H2O
2.4.4. VO2 + HCl → VOCl2 + H2O
2.4.5. NaHSO4 + NaOH → Na2SO4 + H2O
2.4.6. NaOH + H2SO4 → Na2SO4 + H2O
2.4.7. Na2CO3 + HCl → NaCl + CO2 + H2O
2.4.8. Al2O3 + HNO3 → Al(NO3)3 + H2O
2.4.9. CuSO4 + KOH → (CuOH)2SO4 + K2SO4
2.4.10. K2SO3 + HCl → KCl + SO2 + H2O
2.4.11. K2Cr2O7 + KOH → K2CrO4 + H2O
2.4.12. Al2(SO4)3 + NaOH →Al(OH)SO4 + Na2SO4
2.4.13. FeCl3 + NaOH → Fe(OH)2Cl + NaCl
2.4.14. NaOH + Al(OH)3 → Na3[Al(OH)6]
2.4.15. Al2O3 + NaOH → NaAlO2 + H2O
2.4.16. Cr2O3 + H2SO4 → Cr2(SO4)3 + H2O
2.4.17. Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
2.4.18. Zn(OH)2 + KOH → K2[Zn(OH)4]
2.4.19. Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2.4.20. NaHCO3 + NaOH → Na2CO3 + H2O
2.5. Определите, какие продукты и в каком количестве (по массе) получатся при взаимодействии (обратите внимание на избыток одного из реагентов):
2.5.1. 500 г 1% раствора гидроксида кальция и 1 л углекислого газа (н.у.)
2.5.2. 2 г оксида кальция и 200 мл воды
2.5.3. 3 л хлора (Т = 353 К, p = 1,2×105 Па) и 8 г цинка
2.5.4. 200 г 30% раствора серной кислоты и 20 г карбоната кальция
2.5.5. 20 г 15% раствора соляной кислоты и 3 г алюминия
2.5.6. 300 г гидроксида калия и 40 л углекислого газа (н.у.)
2.5.7. 30 л аммиака (н.у.) и 200 г 15% раствора соляной кислоты
2.5.8. 0,5 г лития и 20 мл воды
2.5.9. 15 г магния и 20 л кислорода (t = 25°C, р = 800 мм рт. ст.)
2.5.10. 2 г серы и 8 г железа
2.5.11. 1 г магния и 3 г иода
2.5.12. 200 л хлора и 150 л водорода (н.у.)
2.5.13. 5 л водорода (н.у.) и 3 г оксида меди (II)
2.5.14. 100 г 5% раствора азотной кислоты и 100 г 5% раствора гидроксида натрия
2.5.15. 2,7 г алюминия и 3,2 г серы
2.5.16. 5 г натрия и 200 мл воды
2.5.17. 100 л водорода и 70 л кислорода (н.у.)
2.5.18. 3 г цинка и 200 г 10% раствора соляной кислоты
2.5.19. 5 г серы и 12 л кислорода (t = 0°C, p = 760 мм рт. ст.)
2.5.20. 50 г 3% раствора хлорида натрия и 10 г 7% раствора нитрата серебра.
3. Строение атома и химическая связь
Состояние электрона в атоме характеризуется четырьмя квантовыми числами:
| главное | n = 1, 2, 3, ... |
| орбитальное | l = 0, 1, ... , n – 1 |
| магнитное | m = –l, ... , –1, 0, 1, ... , l |
| спиновое | s = ±1/2 |
Заполнение электронных оболочек в многоэлектронных атомах происходит в соответствии со следующими закономерностями:
Принцип запрета Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Правило Гунда (Хунда): электроны располагаются по вырожденным орбиталям так, чтобы их суммарный спин был максимален.
Правило Клечковского: электроны заполняют подуровни по возрастанию суммы n + l, при равенстве сумм сначала заполняется подуровень с меньшим значением n.
Явление радиоактивности – процесс самопроизвольного распада ядер некоторых элементов. При a-распаде испускается a-частица (ядро 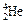 ), заряд ядра уменьшается на 2, массовое число – на 4, образуется элемент, расположенный в Периодической системе на две клетки левее. При b–-распаде испускается электрон, заряд ядра увеличивается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку правее.
), заряд ядра уменьшается на 2, массовое число – на 4, образуется элемент, расположенный в Периодической системе на две клетки левее. При b–-распаде испускается электрон, заряд ядра увеличивается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку правее.
При b+-распаде или К-захвате испускается позитрон или захватывается электрон с ближайшей к ядру оболочки соответственно, заряд ядра уменьшается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку левее.
Теоретическое рассмотрение химической связи возможно в рамках метода валентных связей (ВС) или метода молекулярных орбиталей (МО).
Метод ВС позволяет объяснить строение молекул многих химических соединений. Согласно этому методу химическая связь между атомами осуществляется обобществленными парами электронов с антипараллельными спинами на внешних подуровнях. Этот вид связи называется ковалентной связью (полярной и неполярной). Она характеризуется направленностью и насыщаемостью, что означает определенное расположение атомов в пространстве. Ионная связь возникает в результате электростатического взаимодействия противоположно заряженных ионов.
Метод МО предполагает, что электроны находятся на молекулярных орбиталях, охватывающих все ядра атомов в молекуле. Для двухатомных молекул элементов второго периода МО обозначаются (в порядке увеличения энергии):
2ss < 2ss* < 2py = 2pz < 2sx < 2py* = 2pz* < 2sx*.
Для элементов, находящихся в конце периода, начиная с кислорода, порядок следования МО несколько изменяется: ... < 2sx < 2py = 2pz < ...
3.1. Напишите электронные и электронно-ячеечные формулы валентных электронов атомов следующих элементов в основном и возбужденном
состояниях, определите высшую и низшую степени окисления, приведите
формулы оксидов в высшей степени окисления элемента:
3.1.1. p-элемент VI периода IV группы
3.1.2. p-элемент V периода V группы
3.1.3. p-элемент V периода VII группы
3.1.4. d-элемент IV периода IV группы
3.1.5. p-элемент III периода IV группы
3.1.6. p-элемент III периода VI группы
3.1.7. s-элемент V периода I группы
3.1.8. p-элемент IV периода V группы
3.1.9. p-элемент IV периода IV группы
3.1.10. d-элемент IV периода III группы
3.1.11. s-элемент III периода II группы
3.1.12. p-элемент IV периода VII группы
3.1.13. d-элемент VI периода V группы
3.1.14. s-элемент V периода II группы
3.1.15. p-элемент V периода IV группы
3.1.16. d-элемент V периода VI группы
3.1.17. p-элемент III периода VI группы
3.1.18. d-элемент IV периода VI группы
3.1.19. p-элемент III периода V группы
3.1.20. d-элемент V периода IV группы
3.2. Определите, относится ли данная электронно-ячеечная формула
к основному, возбужденному или невозможному состоянию атома, назовите химический элемент и укажите его порядковый номер:
| 3.2.1. | 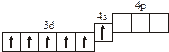
| 3.2.10. | 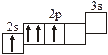
| |
| 3.2.2. | 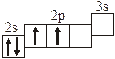
| 3.2.11. | 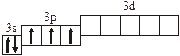
| |
| 3.2.3. | 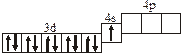
| 3.2.12. | 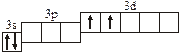
| |
| 3.2.4. | 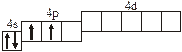
| 3.2.13. | 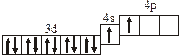
| |
| 3.2.5. | 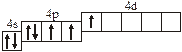
| 3.2.14. | 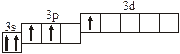
| |
| 3.2.6. | 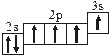
| 3.2.15. | 
| |
| 3.2.7. | 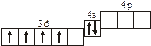
| 3.2.16. | 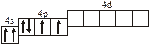
| |
| 3.2.8. | 
| 3.2.17. | 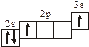
| |
| 3.2.9. | 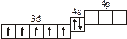
| 3.2.18. | 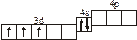
| |
| 3.2.19. | 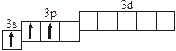
| 3.2.20. | 
| |
3.3. Напишите уравнения ядерных реакций:
3.3.1. 238U + 4He 3n + ... 3n + ... 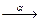 ...
3.3.2. 225Th ...
3.3.2. 225Th 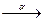 ... ... 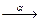 ...
3.3.3. 59Co+4He ...
3.3.3. 59Co+4He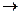 n+... n+...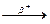 ...
3.3.4. 142Nd+p ...
3.3.4. 142Nd+p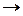 2n+ ... 2n+ ... 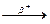 ...
3.3.5. 131Sn ...
3.3.5. 131Sn 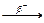 ... ... 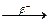 ...
3.3.6. 14N+12C ...
3.3.6. 14N+12C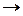 4He+... 4He+... ...
3.3.7. 19F + p ...
3.3.7. 19F + p 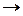 n + ... n + ...  ...
3.3.8. 16O + 14N ...
3.3.8. 16O + 14N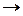 2p+... 2p+...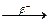 ...
3.3.9. 235U + n ...
3.3.9. 235U + n 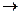 139Ba + 3n + ...
3.3.10. 213Bi 139Ba + 3n + ...
3.3.10. 213Bi 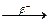 ... ... 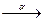 ... ...
| 3.3.11. 30Si+3He 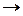 2p+... 2p+...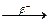 ...
3.3.12. 114Cd + n ...
3.3.12. 114Cd + n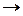 p+... p+...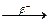 ...
3.3.13. 10B+4He ...
3.3.13. 10B+4He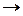 n+.... n+.... ...
3.3.14. 139Xe ...
3.3.14. 139Xe 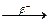 ... ... 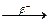 ...
3.3.15. 226Pa ...
3.3.15. 226Pa 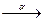 ... ...  ...
3.3.16. 46Ti + 2H ...
3.3.16. 46Ti + 2H n+... n+...  ...
3.3.17. 89Br ...
3.3.17. 89Br  ... ...  ...
3.3.18. 238U ...
3.3.18. 238U 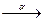 ... ... 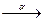 ...
3.3.19. 213Po ...
3.3.19. 213Po 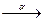 ... ... 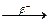 ...
3.3.20. 211Bi ...
3.3.20. 211Bi  ... ...  ... ...
|
6. Растворы
Закон Рауля: 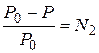 , где P0 – давление насыщенного пара над чистым растворителем; P – над раствором; N2 – мольная доля растворенного вещества.
, где P0 – давление насыщенного пара над чистым растворителем; P – над раствором; N2 – мольная доля растворенного вещества.
Эбулиоскопия: DТкип = KEсm, где KE – эбулиоскопическая константа, сm – моляльная концентрация растворенного вещества; 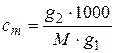 , где g1 – масса растворителя; g2 – масса растворенного вещества; M – молярная масса растворенного вещества.
, где g1 – масса растворителя; g2 – масса растворенного вещества; M – молярная масса растворенного вещества.
Криоскопия: DТзам = KКсm, где КК – криоскопическая константа.
6.1. Определите массовую долю (в %) и молярную концентрацию раствора, содержащего:
6.1.1. 62,5 г соляной кислоты НCl в 250 г воды, r = 1,098 г/мл
6.1.2. 33,3 г щавелевой кислоты H2C2O4 в 300 г воды, r = 1,035 г/мл
6.1.3. 27,8 г формальдегида CH2O в 250 г воды, r = 1,028 г/мл
6.1.4. 20,24 г уксусной кислоты CH3COOH в 200 мл раствора, r = 1,012 г/мл
6.1.5. 79,72 г хлорида калия KCl в 750 мл раствора, r = 1,063 г/мл
6.1.6. 166,7 г этилового спирта C2H5OH в 250 г воды, r = 0,951 г/мл
6.1.7. 100 г глицерина CHOH(CH2OH)2 в 150 г воды, r = 1,097 г/мл
6.1.8. 50 г ортофосфорной кислоты H3PO4 в 200 г воды, r = 1,113 г/мл
6.1.9. 187,4 г метилового спирта CH3OH в 500 мл раствора, r = 0,937 г/мл
6.1.10. 15,0 г сульфата железа (II) FeSO4 в 135 мл раствора, r = 1,110 г/мл
6.1.11. 30 г хлорида железа (III) FeCl3 в 120 г воды, r = 1,182 г/мл
6.1.12. 129 г аммиака NH3 в 500 мл воды, r = 0,923 г/мл
6.1.13. 113,9 г серной кислоты H2SO4 в 500 мл раствора, r = 1,139 г/мл
6.1.14. 62,5 г гидроксида натрия NaOH в 260 г воды, r = 1,219 г/мл
6.1.15. 56,35 г хлорной кислоты HClO4 в 250 мл раствора, r = 1,127 г/мл
6.1.16. 15,1 г сульфата натрия Na2SO4 в 100 мл раствора, r = 1,108 г/мл
6.1.17. 33,45 г азотной кислоты HNO3 в 150 мл раствора, r = 1,115 г/мл
6.1.18. 56,05 г муравьиной кислоты HCOOH в 100 мл раствора, r = 1,121 г/мл
6.1.19. 75 г хлорида натрия NaCl в 300 г воды, r = 1,147 г/ мл
6.1.20. 38,6 г гидроксида калия KOH в 100 мл раствора, r = 1,287 г/мл
6.2. Определите массовую долю (в %) и моляльную концентрацию растворов, полученных смешением:
6.2.1. 60 г 50% раствора и 80 г 20% раствора карбоната калия
6.2.2. 100 г 25% раствора и 120 г 7% раствора иодида кальция
6.2.3. 50 г 60% раствора и 80 г 15% раствора азотной кислоты
6.2.4. 30 г 20% раствора и 50 г 10% раствора гидроксида калия
6.2.5. 100 г 30% раствора и 150 г 10% раствора соляной кислоты
6.2.6. 45 г 60% раствора и 55 г 20% раствора серной кислоты
6.2.7. 100 г 15% раствора и 50 г 7% раствора сульфата меди
6.2.8. 50 г 25% раствора и 20 г 10% раствора хлорида бария
6.2.9. 80 г 20% раствора и 50 г 3% раствора сульфата натрия
6.2.10. 70 г 40% раствора и 50 г 15% раствора пероксида водорода
6.2.11. 55 г 45% раствора и 25 г 15% раствора гидроксида натрия
6.2.12. 50 г 35% раствора и 20 г 5% раствора нитрата калия
6.2.13. 70 г 25% раствора и 30 г 10% раствора сульфата цинка
6.2.14. 40 г 35% раствора и 60 г 25% раствора хлорида лития
6.2.15. 30 г 45% раствора и 80 г 25% раствора иодида натрия
6.2.16. 100 г 15% раствора и 50 г 3% раствора хлорида алюминия
6.2.17. 150 г 40% раствора и 70 г 20% раствора нитрата кальция
6.2.18. 15 г 25% раствора и 100 г 10% раствора нитрата меди
6.2.19. 50 г 30% раствора и 70 г 7% раствора уксусной кислоты
6.2.20. 60 г 45% раствора и 40 г 20% раствора хлорида железа
6.3. Определите относительное понижение давления пара над раствором,
содержащим:
6.3.1. 6,3 г ментола C10H19OH в 150 г ацетона (CH3)2CO
6.3.2. 7,7 г анилина C6H5NH2 в 200 г диэтилового эфира (C2H5)2O
6.3.3. 15 г глицина NH2CH2COOH в 200 г воды
6.3.4. 3,3 г ацетанилида CH3CONHC6H5 в 180 г этилового спирта
6.3.5. 0,7 г ванилина HO(CH3O)C6H3CHO в 120 г воды
6.3.6. 2,2 г гексахлорциклогексана C6H6Cl6 в 100 г диэтилового эфира (C2H5)2O
6.3.7. 3,1 г нитрофенола HOC6H4NO2 в 120 г хлороформа CHCl3
6.3.8. 2,7 г камфоры C10H16O в 75 г метилового спирта CH3OH
6.3.9. 2,2 г пикриновой кислоты (NO2)3C6H2OH в 250 г воды
6.3.10. 13,2 г гексахлорбензола C6Cl6 в 300 г ацетона (CH3)2CO
6.3.11. 10,5 г гидрохинона C6H4(OH)2 в 200 г воды
6.3.12. 4,5 г аскорбиновой кислоты C6H8O6 в 50 г воды
6.3.13. 5,5 г фенола C6H5OH в 120 г этилового спирта
6.3.14. 7,5 г сахарозы C12H22O11 в 180 г воды
6.3.15. 7,2 г янтарной кислоты (CH2COOH)2 в 175 г воды
6.3.16. 5,8 г нитроанилина O2NC6H4NH2 в 250 г пиридина C5H5N
6.3.17. 8,8 г фруктозы CH2OH(CHOH)3COCH2OH в 250 г воды
6.3.18. 1,8 г никотиновой кислоты C5H4NCOOH в 150 г воды
6.3.19. 3,5 г нитроанилина O2NC6H4NH2 в 100 г диэтилового эфира (C2H5)2O
6.3.20. 6,1 г фенилуксусной кислоты C6H5CH2COOH в 100 г этилового спирта
6.4. Найдите температуру кипения раствора, содержащего:
6.4.1. 93,5 г тимола HOC6H3(CH3)C3H7 в 250 г ацетона; KЕ = 1,48; Ткип = 56,0°С
6.4.2. 8,5 г пирокатехина C6H4(OH)2 в 500 г воды; KЕ = 0,52
6.4.3. 412,2 г фруктозы CH2OH(CHOH)3COCH2OH в 1000 г воды; KЕ = 0,52
6.4.4. 0,8 г ацетанилида CH3CONHC6H5 в 50 г диэтилового эфира; KE = 2,02;
Ткип = 34,6°С
6.4.5. 0,5 г нитроанилина O2NC6H4NH2 в 100 г диэтилового эфира; KE = 2,02;
Ткип = 34,6°С
6.4.6. ,2 г анилина C6H5NH2 в 500 г этилового спирта; KE = 1,04; Tкип = 78,3°С
6.4.7. 3,2 г нафталина C10H8 в 100 г диэтилового эфира; KЕ = 2,02; Ткип = 34,6°С
6.4.8. 17,9 г гексахлорбензола C6Cl6 в 250 г ацетона; KЕ = 1,48; Ткип = 56,0°С
6.4.9. 18,6 г анилина C6H5NH2 в 500 г бензола; KЕ = 2,57; Ткип = 80,2°С
6.4.10. 3,5 г камфоры C10H16O в 100 г этилового спирта; KЕ = 1,04; Tкип = 78,3°С
6.4.11. 7,4 г сахарозы C12H22O11 в 200 г метилового спирта; KE = 0,84; Tкип = 64,5°С
6.4.12. 3,5 г ментола C10H19OH в 100 г воды; KE = 0,52
6.4.13. 3,8 г нитрофенола НОС6H4NH2 в 250 г метилового спирта; KE = 0,84;
Tкип = 64,5°С
6.4.14. 6,1 г ванилина HO(CH3O)C6H3CHO в 250 г хлороформа CHCl3; KЕ = 3,80;
Ткип = 61,2°С
6.4.15. 7,2 г фенилуксусной кислоты C6H5CH2COOH в 300 г воды; KE = 0,52
6.4.16. 18,8 г фенола C6H5OH в 400 г этилового спирта; KЕ = 1,04; Tкип = 78,3°С
6.4.17. 6,7 г сахарозы С12H22O11 в 150 г воды; KЕ = 0,52
6.4.18. 16,5 г анилина C6H5NH2 в 400 г диэтилового эфира; KE = 2,02; Ткип = 34,6°С
6.4.19. 4,4 г диоксида селена SeO2 в 200 г ацетона; KЕ = 1,48; Ткип = 56,0°С
6.4.20. 7,8 г нитрофенола HOC6H4NO2 в 500 г этилового спирта; KЕ = 1,04;
Tкип = 78,3°С
6.5. Найдите температуру замерзания раствора, содержащего:
6.5.1. 10,4 г трифенилметана (C6H5)3CH в 400 г тетрахлорида углерода; КК = 29,8;
Тпл = -23°С
6.5.2. 4,67 г сахарозы C12H22O11 в 100 г воды; КK = 1,86
6.5.3. 4,6 г анилина C6H5NH2 в 200 г пиридина; КК = 4,97; Tпл = -41,8°С
6.5.4. 33,6 г динитробензола C6H4(NO2)2 в 1000 г пиридина; КК = 4,97;
Tпл = -41,8°С
6.5.5. 7,4 г глюкозы C6H12O6 в 250 г воды; КK = 1,86
6.5.6. 8,2 г фенилуксусной кислоты C6H5CH2COOH в 400 г воды; КК = 1,86
6.5.7. 1,2 г серы в 40 г бензола; КК = 5,07; Тпл = 5,5°С
6.5.8. 6,4 г камфоры C10H16O в 150 г диэтилового эфира; КК = 1,79; Тпл = -117°С
6.5.9.  8,1 г фруктозы CH2OH(CHOH)3COCH2OH в 100 г воды; КК = 1,86
8,1 г фруктозы CH2OH(CHOH)3COCH2OH в 100 г воды; КК = 1,86
6.5.10. 5,3 г гексахлорциклогексана C6H6Cl6 в 100 г тетрахлорида углерода;
КК = 29,8; Тпл = -23°С
6.5.11. 14 г нафталина С10H8 в 800 г диэтилового эфира; КК = 1,79; Тпл = -117°С
6.5.12. 9,5 г глицина H2NCH2COOH в 200 г воды; КК = 1,86
6.5.13. 18,8 г нитрофенола HOC6H4NO2 в 500 г бензола; КК = 5,07; Тпл = 5,5°С
6.5.14. 2,6 г нитроанилина O2NC6H4NH2 в 100 г пиридина; КК = 4,97; Тпл = -41,8°С
6.5.15. 15 г резорцина C6H4(ОН)2 в 800 г воды; КК = 1,86
6.5.16. 8,8 г янтарной кислоты (CH2COOH)2 в 200 г воды; КК = 1,86
6.5.17. 10,5 г пикриновой кислоты (NO2)3C6H2OH в 500 г ледяной уксусной
кислоты; КК = 3,9; Тпл = 16,7°С
6.5.18. 17 г ментола C10H19OH в 900 г воды; KK = 1,86
6.5.19. 5,4 г бензойной кислоты C6H5COOH в 500 г воды; КК = 1,86
6.5.20. 6,8 г фенола C6H5OH в 400 г воды; КК = 1,86
Теория электролитической диссоциации
Закон разбавления Оствальда: Кдис = a2с/(1 – a) или для очень слабых электролитов Кдис » a2с. Ионное произведение воды: [H+][OH–] = 10–14, pH = –lg [H+]; pOH = –lg [OH–];… 7.1. Запишите уравнения электролитической диссоциации следующих растворов электролитов и определите значение…Примеры решения типовых задач
1.3
| x г | y г | 1 г | |||
| 2NaOH | + | H3PO4 | = | Na2HPO4 | + 2H2O |
| 80 г/моль | 98 г/моль | 142 г/моль |
Для получения 142 г Na2HPO4 нужно взять 80 г NaOH;
для получения 1 г Na2HPO4 нужно взять x г NaOH:
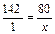 , x = 80:142 = 0,56 (г).
, x = 80:142 = 0,56 (г).
Для получения 142 г Na2HPO4 нужно взять 98 г H3PO4;
для получения 1 г Na2HPO4 нужно взять y г H3PO4:
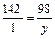 , y = 98:142 = 0,69(г).
, y = 98:142 = 0,69(г).
Ответ.Для получения 1 г гидрофосфата натрия нужно взять 0,56 г гидроксида натрия и 0,69 г фосфорной кислоты.
2.3
| Элемент | K | Mn | O |
| wm, % | 39,67 | 27,87 | 32,46 |
| Ar | 39,10 | 54,94 | 16,00 |
| wm : Ar | 1,015 | 0,507 | 2,023 |
| Целые кратные |
Ответ. K2MnO4.
3.3
При составлении уравнений ядерных реакций соблюдается равенство суммы зарядов и массовых чисел в левой и правой частях уравнения. При этом заряд электрона учитывается со знаком минус, протона и позитрона – со знаком плюс. Нейтрон и гамма-квант заряда не имеют. Кроме того, массы электронов, позитронов и гамма-квантов не учитываются.
Сумма зарядов частиц в левой части уравнения: 92 + 0 = 92 (нейтрон заряда не имеет), значит, ядро нового элемента имеет заряд 92 – 56 = 36 (криптон). Сумма массовых чисел частиц в левой части уравнения: 235 + 1 = = 236, значит, массовое число ядра криптона 236 – 139 – 3 = 94.
Ответ. 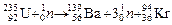 .
.
6.2
Масса полученного раствора m = 70 + 50 = 120 (г).
Масса растворенного вещества m2 = 0,40×70 + 0,15×50 = 35,5 (г).
Массовая доля растворенного вещества wm = 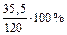 = 29,6%.
= 29,6%.
Масса растворителя m1 = 120 – 35,5 = 84,5 (г).
Моляльная концентрация 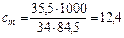 (моль/кг).
(моль/кг).
Ответ. wm = 29,6%; cm = 12,4 моль/кг.
6.3
n1 = 50/18 = 2,778 (моль); n2 = 4,5/176 = 0,026 (моль);
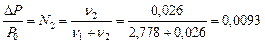 .
.
Ответ. DP/P0 = 0,0093
7.4
Так как для сероводородной кислоты Ka1 = 10–7, то используем приближенную запись закона разбавления Освальда:
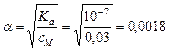 или 0,18%.
или 0,18%.
Ответ. a = 0,18%.
7.5
3Pb(NO3)2 + 2Na3PO4 = Pb3(PO4)2¯ +6NaNO3
3Pb2+ + 6NO3– + 6Na+ + 2PO43– = Pb3(PO4)2¯ + 6Na+ + 6NO3–
3Pb2+ + 2PO43– = Pb3(PO4)2¯
ПР = [Pb2+]3×[PO43–]2
При смешении равных объемов растворов концентрация каждого из них уменьшается в два раза.
K’ = 0,000053×0,000052 » 3×10–22
K’ > ПР, значит, выпадает осадок.
Ответ. Выпадает осадок Pb3(PO4)2.
Литература
1. Глинка Н.Л. Общая химия. Уч. пособие. Л.: Химия, 2009. 752 с.
2. Громов Ю.Ю. и др. Сборник задач и упражнений по общей химии. Тамбов: Изд-во ТГТУ, 2007. 80с.
3. Коровин Н.В. Общая химия. Учебник. М.: Высш. шк., 2007. 557 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии. Л.: Химия, 1983. 264 с.
5. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. В 2-х т.
М.: Мир, 1982. Т.1. 652 с.; Т.2. 620 с.