СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
(CuОН)2СО3.
Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома; долька яблока уже через несколько часов покрывается бурой плёнкой; петарда, брошенная в костёр, оглушительно взрывается.
Любопытно, что с точки зрения химической термодинамики возможны все перечисленные процессы, даже окисление золота. Просто у них разные скорости. Одной реакции требуются для завершения микросекунды, другой — миллионы лет. Почему так? Термодинамика ответить бессильна: в этой теории не учитывается время. Скорости химических реакций изучает химическая кинетика. Более того, химическая кинетика даёт ключ к управлению реакцией.
Для количественной характеристики скорости реакции используют не время её протекания, а другую величину — скорость изменения количества вещества (в молях) в единице объёма. Если за время At в объёме V образовалось Dn молей молекул продукта, то среднюю скорость реакции w можно определить как
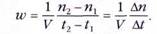
Когда реакция идёт при постоянном объёме, её скорость выражают через изменение молярной концентрации (с=n/V) любого из продуктов или исходных веществ:

Для продукта реакции с2>с1, в случае же исходного вещества с2<c1 поэтому в выражение скорости ставят знак «-», чтобы величина w была положительна.
