рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- ВЕЩЕСТВО И ЭЛЕКТРИЧЕСТВО
Реферат Курсовая Конспект
ВЕЩЕСТВО И ЭЛЕКТРИЧЕСТВО
ВЕЩЕСТВО И ЭЛЕКТРИЧЕСТВО - раздел Образование, Вещество И Электричество...
ВЕЩЕСТВО И ЭЛЕКТРИЧЕСТВО
До работ Гальвани и Вольта электричество в лаборатории умели получать единственным способом — путём трения одного предмета о другой. Лучше других… Изучать с помощью статических зарядов действие электричества на различные… ЧТО ИМЕННО ОТКРЫЛ ЛУИДЖИ ГАЛЬВАНИ?Опыт Л. Гальвани. Гравюра. 1791 г.
СОЗДАНИЕ ВОЛЬТОВОЙ БАТАРЕИ Эстафету исследований принял у Гальвани его соотечественник — физик Вольта.… только два металла приводили в контакт с помощью проволоки, сразу же во рту ощущался кислый вкус. Когда металлы на…Алессандро Вольта.
*ЭДС — напряжение источника тока в отсутствие внешней нагрузки.
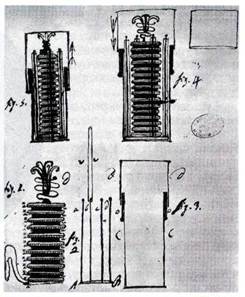
Вольтов столб. Чертёж из рукописи А. Вольта.
Вольта обнаружил, что при сочетании меди и цинка получаются «сильные» элементы, а из меди и серебра — «слабые». Исследовав многие проводники, он расположил их в ряд, известный… ВОЛЬТОВ СТОЛБ — ВЕЧНЫЙ ДВИГАТЕЛЬ?Гемфри Дэви.
Тем не менее, используя свою гигантскую батарею, Петров провёл множество экспериментов: он разлагал током различные вещества, в том числе… стеклянную плитку или на скамеечку со стеклянными ножками, — писал Петров, —… Работы Петрова поставили его в один ряд с выдающимися учёными начала XIX в. В 1803 г. он был избран…С медными электродами. На катоде происходит выделение меди, а материал анода растворяется.
Электролиз расплава NaCl.
На катоде выделяется натрий, а на аноде — хлор.
МАЙКЛ ФАРАДЕЙ (1791—1867)Количество выделившегося при электролизе вещества пропорционально количеству пропущенного электричества и атомной массе с учётом валентности.
В наши дни количество израсходованной электроэнергии измеряет всем знакомый счётчик. Чем больше электричества пройдёт через него, тем больше… Пропускать весь ток через электрохимическую ячейку было невыгодно: она сильно… Раз в месяц электрик обходил потребителей, вставлял заранее взвешенные новые катодные пластинки, а отработанные…Лаборатория М. Фарадея. Гравюра. XIX в.
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Алессандро Вольта опытным путём установил ряд напряжений металлов: Zn, Pb,… В 1853 г. русский учёный, один из основоположников физической химии Николай Николаевич Бекетов (1827—1911) сделал в…В растворе ацетата свинца цинковый ёршик начинает обрастать мельчайшими кристалликами металлического свинца: Pb(CH3COO)2+Zn=Pb+ Zn(CH3COO)2. Более активный цинк вытесняет свинец из раствора его соли.

Ряд напряжений металлов.
Вначале Бекетов решил, что основная закономерность такова: более лёгкие металлы способны вытеснять из растворов солей металлы с большей… Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий… Чтобы определить стандартный электродный потенциал металла, измеряют электродвижущую силу гальванического элемента,…ЭТИ ЗАГАДОЧНЫЕ КОЛЛОИДЫ
XIX в., когда химики открыли много новых коллоидов, казалось, что идея Грэма торжествует. Однако в начале XX в. она была отвергнута. Как выяснилось, из одного и того же вещества можно приготовить и обычный, и коллоидный раствор. Просто в обычных…Томас Грэм.
Щелевой ультрамикроскоп — прибор для обнаружения в прозрачной жидкости или газе взвешенных частиц размером до 0,005 мкм, т. е. в десятки раз меньше, чем те, что видны в обычный микроскоп. Препарат освещается сбоку так, чтобы в глаз наблюдателя попадали только рассеянные этими частицами лучи. Освещённая частица видна как яркая звёздочка на тёмном фоне.

Коллоидные растворы (золи) золота.
КОЛЛОИДНЫЕ СИСТЕМЫ Мир коллоидных систем широк и разнообразен. Крайне редки газы, жидкости или… Коллоидные растворы именуются золями. В них мелкие твёрдые частицы, размером от 1 до 100 нм, распределены в жидкой…Пенопласт, хозяйственные губки — примеры коллоидных систем, которые окружают нас повсюду.
ЖИДКОЕ ИЛИ ТВЁРДОЕ?
При высоких концентрациях частицы в жидких коллоидах начинают соприкасаться и образуют сеточные структуры. Так получаются студни, или гели (от лат. gelare — «застывать»). Фруктовое желе и гель для укладки волос — типичные примеры подобных систем. Гелеобразную структуру имеет даже головной мозг. Недаром видный представитель отечественной коллоидной химии Иван Иванович Жуков (1880—1949) говорил, что «человек — ходячий коллоид».
Уникальное свойство гелей заключается в том, что они, несмотря на подавляющее преобладание жидкости, имеют многие свойства твёрдого тела, такие, как прочность и упругость. В отличие от материалов с кристаллической структурой, гели способны восстанавливать исходную структуру после её временного разрушения. Это свойство называется тиксотропией (от греч. «тиксис» — «прикосновение» и «тропе» — «изменение»). Оно обеспечивается именно жидкими прослойками между частицами, образующими гель.
Чтобы кефир легко вылился из бутылки с узким горлышком, надо энергично потрясти её. Если же после этого бутылка примерно час постоит на столе, то кефир из неё не выльется. Причина — тиксотропный эффект: в неподвижном кефире постепенно восстановились контакты между частицами вещества-загустителя, которые были разрушены при механическом воздействии. Именно поэтому на некоторых микстурах написано: «Перед употреблением взбалтывать».
ДИФФУЗИЯ
ПРОТИВ СЕДИМЕНТАЦИИ
В 1845 г. английский учёный Майкл Фарадей получил золь золота — коллоидные частицы металла размером менее 0,1 мкм, взвешенные в воде. Плотность золота почти в 20 раз больше, чем воды, поэтому все частицы, даже самые мелкие, казалось бы, должны постепенно осесть на дне сосуда. Однако сам Фарадей за несколько лет наблюдений не обнаружил образования осадка. Более того, эти золи сохранились до сих пор и демонстрируются в Британском музее! Причина такой стабильности золей была найдена только спустя 70 лет после опыта Фарадея. Закон Архимеда, разумеется, справедлив и для коллоидов: под действием силы тяжести твёрдые частицы начинают оседать, и в нижней части сосуда их концентрация возрастает, а в верхней — уменьшается. Из-за разности концентраций
тепловое движение частиц, или диффузия (от лат. diffusio — «распространение», «растекание»), приобретает направленный характер — снизу вверх. Так что в системе протекают два противоположно направленных процесса: седиментация (от лат. sedimentum — «оседание») и диффузия. Когда их скорости сравниваются, наступает динамическое равновесие. В результате достаточно малые частицы, активно участвующие в диффузии, в осадок не выпадают. Теорию седиментационно-диффузионного равновесия предложил и подтвердил экспериментально французский физик Жан Батист Перрен, награждённый за эту работу в 1926 г. Нобелевской премией по физике.
И всё же можно заставить осесть даже очень малые (менее 0,1 мкм) коллоидные частицы. Для этого используют центрифуги с большим числом оборотов — свыше 100 тыс. в минуту (они называются ультрацентрифугами). Центробежное ускорение, развиваемое в них, способно в сотни и тысячи раз превысить ускорение силы тяжести. В этих условиях диффузия уже не в силах противостоять седиментации.
ЖИЗНЬ И СМЕРТЬ КОЛЛОИДА
Благодаря малому размеру коллоидных частиц общая площадь их поверхности может быть очень велика. Отношение общей поверхности к массе частиц (оно называется удельной поверхностью Sуд ) резко возрастает при уменьшении размера частиц. Так, для капель воды диаметром 1 мкм Sуд = 6000 м2/кг, т. е. общая поверхность литра мелких водяных капель в 10 раз больше участка в шесть соток! Тончайший поверхностный слой всегда имеет более высокую энергию, чем вещество во внутреннем объёме тела. Ведь молекулы, расположенные на поверхности, взаимодействуют только с соседями снизу и сбоку, так что у них остаётся «неистраченная сила». Избыточная энергия, отнесённая

В коллоидной системе со временем устанавливается равновесие между процессами диффузии и седиментации.

Центрифуга — аппарат для механического разделения смесей под действием центробежной силы.
На лекциях по коллоидной химии, которые замечательный советский химик, академик Пётр Александрович Ре'биндер (1898—1972) читал на химическом… Сам автор назвал своё открытие скромнее: «эффект адсорбционного понижения… Эффект Ребиндера имеет большое практическое значение. Именно им объясняется хрупкое разрушение металлов,…Пётр Александрович Ребиндер.
ведущие к «сбросу» этого избытка. Подобное происходит, например, при уменьшении удельной поверхности. Значит, в коллоидной системе термодинамически…Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую форму.
Капли в аэрозолях и эмульсиях, пузырьки в жидкости, совершая броуновское движение, периодически соприкасаются и сливаются в более крупные. Такой… Коалесценция и коагуляция ведут к агрегации (от лат. aggrego —… Для разного рода прикладных задач может оказаться важным как сохранить коллоид (т. е. не позволить ему расслоиться…Выделение сливок на поверхности молока — пример нарушения седиментационно-диффузионного равновесия в эмульсии.

Форма поверхности застывшего окрашенного воска.
Искривление поверхности — образование мениска —
Результат действия двух сил: поверхностного
Натяжения и взаимодействия со стенкой
Фарфорового стаканчика.

Существуют способы «продления жизни» коллоидных систем. Эмульсии, например, стабилизируют с помощью
поверхностно-активных веществ.
МОЛЕКУЛЫ-ПОГРАНИЧНИКИ
Поверхностно-активные вещества (ПАВ) получили ныне широкое распространение — промышленность производит их примерно по 3 кг в год на каждого жителя Земли. Используются ПАВ как моющие средства, в качестве эмульгаторов, способствующих образованию эмульсий, флотационных реагентов (для обогащения полезных ископаемых, мелкие частички которых переходят в пенный слой), косметических средств и т. д.
Есть у этих веществ и другое название — сурфактанты (от англ. surface-active agent, или surfactant, — «поверхностно-активный агент»). «Любимое занятие» таких соединений — найти поверхность раздела между жидкостью и газом или между двумя несмешивающимися жидкостями и тут же устроиться на этой границе поудобнее. Подобному поведению способствует двойственная природа молекул ПАВ: с одной стороны, они содержат гидрофильные (т. е. «водолюбивые») группы, например — СООН, которые «тянут» молекулы в воду; с другой — в составе тех же молекул (часто на значительном отдалении) имеются гидрофобные («боящиеся воды») группы, например углеводородные цепочки, которые способствуют растворению ПАВ в неполярных жидкостях. Эта двойственность и объясняет особенности поведения молекул: наиболее «комфортно» они чувствуют себя именно на границе раздела двух фаз, где гидрофильные группы «погружены» в водный раствор, а гидрофобные обращены в сторону неполярной фазы (воздух, масло, бензин и т. п.).
А что получится, если молекулам ПАВ не предоставить границы раздела? Или если их в растворе намного больше, чем может разместиться на конкретной границе? В таком случае десятки, а то и сотни молекул собираются в шарообразные скопления — мицеллы (от лат. micella — «маленькая частичка»). Если это происходит в водной среде, углеводородные цепи ПАВ объединяются в компактное ядро, а полярные группы образуют внешнюю оболочку, обращённую к жидкости. В результате вода не контактирует с углеводородными группами: молекулы ПАВ сами создали нужную им границу раздела.
Мицеллы обладают типичными свойствами коллоидных систем; их образование можно иногда зафиксировать невооружённым глазом. Так, если постепенно добавлять мыло в воду, то при достижении определённой концентрации, называемой критической, светорассеяние раствора увеличивается, он мутнеет. Это верный признак коллоидного раствора, содержащего мицеллы.
Не все поверхностно-активные вещества «умеют» создавать мицеллы — для этого необходимо определённое соотношение между углеводородным «хвостом» и полярной группой. К мицеллообразуюшим относятся, например, натриевые и аммониевые соли жирных кислот с 12—20 атомами углерода в цепи. Так, олеат натрия (соль олеиновой кислоты) способен порождать устойчивые мицеллы диаметром около 5 нм. Одновременно с ними в растворе могут присутствовать также молекулы ПАВ, образующие истинный раствор, однако их концентрация
обычно невелика: количество вещества в мицеллярной форме может в тысячи раз превышать его количество в виде раствора.
Механизмы появления и разрушения мицелл важно знать, чтобы улучшать моющие свойства ПАВ. Другое интересное применение мицелл — ускорение химических реакций (мицеллярный катализ). Это происходит благодаря увеличению концентрации реагирующих веществ, молекулы которых входят внутрь мицелл, причём скорость реакции может увеличиться на два-три порядка по сравнению с идущей в растворе. Если же один из реагентов входит в состав мицелл, а другой остаётся в растворе, скорость реакции между ними резко уменьшается.
Джон У. Хилл, преподаватель химии из штата Висконсин (США), поясняет образование мицелл с помощью забавной аналогии. «Вы знаете, — говорит он ученикам, — что в полярных областях Северной Америки обитает овцебык — большое лохматое животное. Его основной враг — волк. При угрозе нападения хищников на стадо взрослые овцебыки образуют защитный круг. При этом они становятся так, что их хвосты обращены внутрь круга, где в безопасности находятся самки и детёныши, а рогатые головы — в сторону враждебного полярного мира. Точно так же прячут свои „хвосты" от полярной водной среды молекулы мыла и других подобных веществ, когда они образуют мицеллы. „Головы" же молекул обращены наружу, в сторону воды — полярного и неприветливого для молекул внешнего мира».
КОЛЛОИДНАЯ ХИМИЯ НА СТРАЖЕ ЗДОРОВЬЯ
Коллоидная химия очень важна для решения многих проблем биологии и медицины. Приведём только один пример. Немало людей страдает от образования тромбов в кровеносной системе и в сердце. Тромбы — это сгустки крови, которые формируются при определённых биохимических отклонениях, оседают на стенках сосудов и прочно закрепляются на них. Они суживают сечение артерий и капилляров, сильно затрудняя кровообращение, и в конце концов могут привести к полной закупорке сосудов. Чтобы предотвратить это заболевание, кроме чисто медицинских аспектов необходимо учитывать и особенности коллоидно-химических процессов. Поскольку кровь — типичная коллоидная система, образование тромба нужно рассматривать как потерю устойчивости с последующей коагуляцией. Исходя из этого и разрабатываются современные методы профилактики и лечения.
П. А. Ребиндер назвал эти защитные слои структурно-механическим барьером. Примером могут служить белки, находящиеся в молоке: молекулы белков адсорбируются на капельках жира и на длительный срок предотвращают их слияние. Чтобы удалить с жировых капель защитный слой белка и получить таким образом сливочное масло, необходимо приложить значительные механические усилия.
Закончим рассказ о коллоидах провидческими словами Д. И. Менделеева, сказанными ещё в 1871 г.: «Вопросы коллоидной химии должно считать передовыми и могущими иметь значение во всей физике и химии».
ТЕПЛО ХИМИЧЕСКИХ РЕАКЦИЙ
Иногда выделение энергии в химических реакциях даже важнее образования новых веществ. Пример — реакции горения топлива, имеющие огромное… ЧТО ТАКОЕ ТЕПЛОТА Теплота знакома каждому из нас с детства. Однако её природа совсем не так проста, как кажется.И температуру, и крепость спиртных напитков измеряют в градусах.
Альтернативой теории теплорода стала молекулярно-кинетическая теория, сторонником которой был М. В. Ломоносов. Она связывала теплоту с движением… В конце XVIII в. опытным путём было доказано, что «количество теплоты» в… В 1799 г. подобные эксперименты провёл и знаменитый английскийРудольф Юлиус
Эмануэль Клаузиус.
Всякий объект, который изучает термодинамика, называется термодинамической системой. Система — это некоторая часть материального мира,… Состояние системы характеризуется термодинамическими параметрами:…Юлиус Роберт Майер.
«Мысль об этом законе пришла Майеру внезапно в июле 1840 г., — свидетельствует историк физики Марио Льоцци, — она стала для него как бы религиозным… Количественное соотношение между теплотой и работой — знаменитый…Джеймс Прескотт Джоуль
В Международной системе единиц (СИ) нет необходимости пользоваться понятием механического эквивалента теплоты, поскольку здесь для измерения как… По конечному состоянию системы нельзя определить, что повлияло на изменение её… Внутренняя энергия является свойством системы и зависит только от её состояния (иными словами, это функция состояния…Кажется, что теплота, выделяющаяся при горении, возникает ниоткуда, подобно предметам, появляющимся из шляпы фокусника. Эта теплота заключена в химических связях.
ГЕРМАН ИВАНОВИЧ ГЕСС
(1802—1850)
«Каким бы ни было исследуемое вещество, термохимия открывает новые возможности для наших исследований. Она по своей природе является для химии тем же, чем микроскоп для натуралиста, подзорная труба для астронома» — такие слова прочёл французский физик и астроном Доминик Франсуа Араго в письме, полученном в январе 1841 г. от Германа Гесса.
Предшествующий, 1840 г., стал для русского учёного поистине «звёздным». Он сформулировал два основных закона термохимии: закон постоянства сумм тепла и закон термонейтральности. Согласно первому, количество тепла, выделяющееся в ходе химической реакции, зависит только от природы исходных веществ и продуктов реакции и не зависит от промежуточных химических превращений в системе. В соответствии со вторым, при смешении растворов двух нейтральных солей, образующих при обменном разложении
две новые соли, изменения температуры не происходит. Тем самым Гесс вошёл в число создателей современной термохимии. В истории отечественной науки его роль трудно переоценить: именно он положил начало систематическим химическим исследованиям в России и в огромной степени способствовал развитию химического образования.
С Россией связана вся жизнь Гесса. Когда мальчику исполнилось три года, его отец, швейцарский художник, навсегда переселился в нашу страну. В 1825 г. Гесс окончил Дерптский университет со степенью доктора медицины. Как «особо талантливому и одарённому учёному» ему предоставили командировку в стокгольмскую лабораторию Якоба Берцелиуса. Именно там у молодого практиканта возник интерес к изучению тепловых явлений, сопровождающих химические процессы. Так что вернувшись в Петербург, Гесс уже чётко видел цель своих будущих исследований.
В 1831 г. он написал «Основания чистой химии» — фактически первый
оригинальный учебник по химии на русском языке. Книга выдержала семь изданий (последнее — в 1849 г.). По ней училось целое поколение российских химиков, в том числе и Дмитрий Иванович Менделеев. Между прочим, в седьмом издании Гесс предпринял первую в России попытку систематизации химических элементов, объединив все известные неметаллы в пять групп. Он полагал, что «подобная классификация может быть распространена и на металлы». Велики заслуги Гесса и в создании русской химической номенклатуры.
«Гесс имел характер прямой и благородный, душу, открытую для возвышеннейших человеческих наклонностей... Мы имели случай не раз удивляться гибкости, своеобразности и глубине его ума, разносторонности его познаний, правильности его возражений и искусству, с которым он умел по воле своей направлять и услаждать беседу» — такие проникновенные слова написал один из его друзей после кончины учёного.
Отметим, что реакции, в которых исходные вещества и продукты находятся в жидком или твёрдом состоянии, протекают без существенных изменений объёма, т. е. DV»0 и pAV»0. Для таких процессов DH»DU. Если же в реакции участвуют газы, то изменение объёма может быть значительным, и в этом случае DН и DU сильно отличаются.
Внутреннюю энергию и энтальпию, как правило, выражают в килоджоулях на моль исходного или полученного вещества.
Тепловой эффект химической реакции называется стандартным (обозначается символом «°», например DН°), если все участники реакции находятся в стандартных состояниях.
ЗАКОН ГЕССА
Важнейшим постулатом термохимии является закон Гесса, или закон постоянства сумм тепловых эффектов реакций, установленный в 1840 г. русским химиком Германом Ивановичем Гессом. Он гласит:
Тепловой эффект химической реакции зависит только от начального и конечного состояний системы и не зависит от промежуточных химических превращений в системе (т. е. от пути перехода от начального состояния к конечному).
При этом исходные вещества и продукты должны находиться в одинаковых условиях (давление, температура). Закон Гесса, хотя и был сформулирован раньше первого закона термодинамики, по сути, является его следствием и отражает тот факт, что тепловой эффект реакции равен изменению внутренней энергии или энтальпии, которые есть функции состояния, не зависящие от пути перехода из одного состояния в другое.
Закон Гесса позволяет вычислять тепловые эффекты реакций, если по
* Стандартным состоянием в термодинамике считается состояние вещества при давлении 1,013•105 Па (1 атм) и заданной температуре (обычно 25 °С, или 298,15 К), а для твёрдых простых веществ — наиболее устойчивая аллотропная модификация (например, для углерода — графит, а не алмаз). Исключением является фосфор, для которого выбирается не наиболее устойчивая, а наиболее воспроизводимая модификация — белый фосфор. Энтальпия образования простых веществ в стандартном состоянии принимается равной нулю.
какой-либо причине это невозможно сделать экспериментально. Для этого «неизмеряемую» реакцию нужно скомбинировать из нескольких «измеряемых». Например, непосредственно измерить тепловой эффект реакции С (тв)+0,5О2 (г)®СО (г) при сжигании твёрдого углерода (тв) в эквивалентном количестве газообразного кислорода (г) не удаётся, поскольку наряду с СО всегда образуется и СО2. Однако тепловой эффект данной реакции можно рассчитать, измерив его у двух других реакций:
С (тв)+О2 (г) ®СО2 (г) DН°=-393,5 кДж/моль
СО (г) + 0,5О2 (г) ®СО2 (г) DН°=-283,0 кДж/моль.
Вычитая из первого уравнения второе, получим искомое уравнение и искомый тепловой эффект:
С (тв) + 0,5 О2 (г) ® СО (г) DН° = -110,5 кДж/моль.
Все три реакции горения протекают с выделением тепла, т. е. являются экзотермическими. Знак «минус» показывает, что теплота уходит из системы.
ЧЕЛОВЕК
КАК ТЕПЛОВАЯ МАШИНА
Первый закон термодинамики соблюдается для любых систем, в том числе и живых организмов.
Протекание жизненных процессов требует затрат энергии. Единственным источником энергии для живого организма служит пища. Хорошо знакомая всем калорийность пищевых продуктов — не что иное, как теплота их сгорания, которую можно измерить в калориметрической бомбе (см. дополнительный очерк «Как измеряют теплоту»).
Ранее теплоту измеряли в калориях. Теперь общепринятой единицей для всех видов энергии становится

Герман Иванович Гесс.
Количество теплоты измеряют по её переносу от одного тела к другому. Повышение температуры тела определяется его теплоёмкостью: С = Q/DT, где С —… Тепловые эффекты химических реакций измеряют с помощью специальных приборов —… Простейший калориметр — теплоизолированный сосуд с водой, снабжённый мешалкой и особо точным термометром. Контейнер,…Пламенный калориметр.
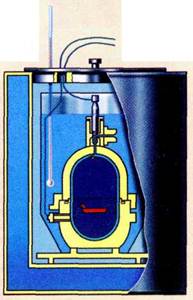
Калориметрическая бомба.
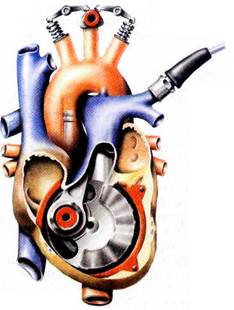
Живой организм — это тоже своего рода тепловая машина.
Начало таким измерениям положили Антуан Лавуазье и Пьер Симон Лаплас в 1780 г. Определяя с помощью калориметра количество теплоты, выделенное… был сделан важный вывод: живой организм выделяет теплоту за счёт окисления в… Конечно, окисление питательных веществ в организме протекает совсем не так, как в калориметре. Это сложные…БЫТЬ ИЛИ НЕ БЫТЬ РЕАКЦИИ? ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
имеют отношение к возникновению жизни на Земле и эволюции звёзд. Альберт Эйнштейн считал термодинамику единственной общей физической теорией и… Термодинамика изучает процессы взаимного превращения разных видов энергии, и… лообмена было впервые обнаружено такое фундаментальное свойство природных процессов, как необратимость:…С необратимыми процессами мы сталкиваемся ежедневно. Увядание цветка, старение человека — лишь некоторые из них.

Людвиг Больцман.
Оказывается, правило таково: самопроизвольные процессы всегда сопровождаются преобразованием энергии в более неупорядоченную форму. Иначе говоря,… ЧТО ТАКОЕ ЭНТРОПИЯ Для описания степени беспорядка используется особая термодинамическая функция, называемая энтропией и обозначаемая…Невозможен самопроизвольный переход теплоты от холодного тела к горячему.
Уильям Томсон, лорд Кельвин.
Как видим, формулировки Клаузиуса и Кельвина накладывают определённые ограничения на использование теплоты для производства работы и обосновывают… Для химиков более удобны другие формулировки закона. Так, второй закон… Энтропия изолированной системы в самопроизвольном процессе возрастает, т. е. её изменение больше нуля: DS>0.Вечный двигатель. Старинная гравюра.
DS>0 — реакция протекает самопроизвольно; DS=0 — реакция находится в состоянии равновесия; DS<0 — реакция самопроизвольно не протекает.Энтропия — царица хаоса.
При протекании химической реакции кроме изменения энтропии самой системы необходимо учитывать её изменение в окружающей среде. Если систему и её… DSобщ=DSсист+DSокр>0. Как же вычислить изменение энтропии окружения? Удобнее всего выразить его через свойства системы. Если количество…Джозайя Уиллард Гиббс.
запрещена, нет смысла даже искать катализатор. Проблемой изучения скоростей и механизмов химических
реакций занимается другая область физической химии — химическая кинетика.

Бронзовый памятник во влажном воздухе медленно покрывается налётом основного карбоната меди
ВРЕМЯ В ХИМИИ:
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду… Любопытно, что с точки зрения химической термодинамики возможны все… Для количественной характеристики скорости реакции используют не время её протекания, а другую величину — скорость…Надрезанное яблоко на воздухе быстро покрывается коричневой плёнкой органических полиоксидов.
Эти формулы позволяют рассчитать среднюю скорость реакции за любой временной промежуток, если известна зависимость концентрации от времени. При… Так, для реакции 2N2O5=4NO2+О2Графическое определение скорости образования NO2 при распаде N2O5. В начале реакции скорость больше, чем в середине процесса.
СаСО3+2СН3СООН=(СН3СОО)2Са+СО2+Н2О, то за ней удобно наблюдать, измеряя объём выделившегося газа. Когда в реакции… Иногда зависимость концентрации от времени определяют методом остановки реакции. Её, например, «замораживают», резко…Прибор для измерения скорости реакции растворения мела в уксусной кислоте.
Во многих случаях реакции можно ускорить или замедлить с помощью специальных веществ — катализаторов. Они изменяют скорость реакции, направляя её… ЗАКОН ДЕЙСТВУЮЩИХ МАСС Для того чтобы количественно описать зависимость скорости от концентрации, надо понять, как «устроены» химические…Чем выше концентрация соляной кислоты, тем быстрее протекает растворение в ней металлического цинка.

Механизм бимолекулярной реакции.
ТЕОРИЯ СТОЛКНОВЕНИЙ Если реакции протекают при столкновении молекул, то скорость реакций должна… Встречи двух частиц длятся не более 10-12 с, частота же двойных соударенийПри повышении температуры доля молекул, энергия которых превышает значение энергии активации, быстро растёт.
Третий множитель в этой формуле учитывает долю активных молекул (E — энергия, необходимая для реакции).
Больше трёх частиц одновременно столкнуться не могут, поэтому других элементарных реакций не бывает.
Теория столкновений помогает понять, как влияет концентрация на скорость элементарных реакций. Для них эта зависимость выражается законом действующих масс:
Скорость элементарной реакции пропорциональна произведению концентраций реагирующих молекул.
В зависимости от числа молекул, участвующих в элементарной реакции, закон действующих масс может иметь следующий вид: w=k•[X] — для мономолекулярных, w=k•[X]•[Y] — для бимолекулярных,Кинетические кривые для реакции первого (1), второго (2) и третьего (3) порядков.
Чтобы найти зависимость концентраций реагентов от времени, на- до решить дифференциальное уравнение. Например, все реакции первого порядка… В реакциях первого порядка концентрация вещества убывает по экспоненциальному закону: за равные промежутки времени…Скорость сложной реакции пропорциональна произведению концентраций реагирующих молекул, возведённых в некоторые степени.
Необычный — дробный или отрицательный — порядок реакции однозначно указывает на её сложный механизм. Но иногда порядок сложной реакции может… СКОРОСТЬ РЕАКЦИИ И ТЕМПЕРАТУРАСкорость многих реакций при нагревании на 10 °С увеличивается в 2—4 раза.
Так, при повышении температуры с 30 до 40 °С скорость гидролиза сахарозы в присутствии кислоты возрастает в 3,9 раза.
Математически правило Вант-Гоффа можно записать в виде степенной зависимости:
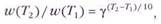

Скорость реакции сильно зависит от температуры. В холодном климате химические реакции, обусловливающие созревание яблок, протекают гораздо медленнее, чем в жарком.

Взаимодействие сурьмы с бромом:
1 — при комнатной температуре;
При нагревании.
Однако правило Вант-Гоффа справедливо лишь при небольшом изменении температуры и далеко не для всех реакций. Гораздо более точно описывает… где А и ЕА — постоянные величины, которые не зависят от температуры, а определяются только природой реагирующих…Константа скорости химической реакции быстро возрастает с повышением температуры.

Энергия частицы, участвующей в химической реакции, меняется подобно тому, как это происходит у шара для гольфа, катящегося по неровной поверхности игрового поля и попадающего в лунку. Своеобразной энергетической «лункой» для частицы является образование устойчивого продукта реакции.
КОГДА СОСТАРЯТСЯ ПОКРЫШКИ?
Срок хранения автомобильных покрышек при температуре 20 °С — 5 лет, а при температуре 10 °С — 13 лет. Сколько лет можно хранить покрышки при 5 °С?
Средняя скорость старения резины обратно пропорциональна сроку хранения. Следовательно, при охлаждении с 20 до 10 °С скорость старения уменьшится в 13/5=2,6 раза. Это означает, что температурный коэффициент у = 2,6. При охлаждении ещё на 5 °С скорость реакции упадёт в g1/2 в g1/2=1,6 раза:
w (10 °C)/w(5 °С) = g(10-5)/10 = g1/2 = 1,6.
В такое же число раз возрастёт срок хранения покрышек, который в этом случае составит уже 13•1,6=21 год.
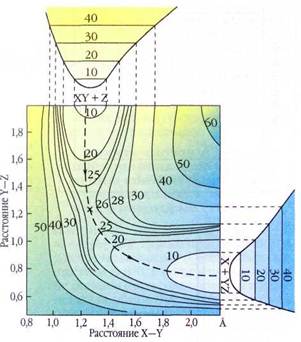
Контурная карта поверхности потенциальной энергии для реакции
X+YZ®XY+Z.
исходных веществ к продуктам в элементарной реакции. А можно выразиться ещё проще: переходное состояние — это уже не реагенты, но ещё не продукты.

Энергетическая кривая, показывающая изменение энергии ядер в ходе химической реакции.
В школьных учебниках зависимость скорости реакции от температуры описывается правилом Вант-Гоффа. Однако в подавляющем большинстве изданий по… Дело в том, что для очень многих реакций правило Вант-Гоффа не выполняется.… только в 1,8 раза при повышении температуры от 453 до 463 К (180—190 °С). Если же рассмотреть реакцию С2Н6+С2Н4=2С2Н5…Соотношение между энергией активации и температурой, при котором выполняется правило Вант-Гоффа.
энергия активации обратной реакции. Разность между энергиями исходных веществ и продуктов равна тепловому эффекту реакции. Поверхности потенциальной энергии обычно многомерны, т. е. зависят от многих… X+YZ®XY+Z,Классические траектории движения ядер. Области существования переходного комплекса выделены цветом. Слева — модельная реакция А+ВС®АВ+С. Атом А сталкивается с колеблющейся молекулой ВС, при этом образуются
Колеблющаяся молекула АВ и атом С. Справа — реальная реакция KCl+NaBr®KBr + NaCl.

Полутяжёлая вода — вода, в состав молекулы которой входит один атом водорода и один атом дейтерия.
Химия не только изучает окружающий мир, но и активно видоизменяет его, создавая новые материалы, процессы и реакции. В этом смысле современная… Для решения этой задачи надо знать различные путиреакции, т. е. иметь в своём… С другой стороны, химики научились произвольно изменять направление некоторых реакций. Так, используя определённую…ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Если смешать растворы кислоты и щёлочи, образуются соль и вода, например: НСl+NaOH=NaCl+H2O. Если же попытаться провести реакцию хлорида натрия с… NaCl+Н2О®t°NaOH+HCl.) Практически необратимы при комнатной температуре очень многие реакции:Яркий пример динамического равновесия — природный водоём. Хотя из озера Байкал вытекает река Ангара и вода с его поверхности постоянно испаряется, уровень воды в озере не понижается многие десятки лет — озеро подпитывается атмосферными осадками, реками и водами подземных источников.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ — РЕАКЦИЯ ПРОДОЛЖАЕТСЯ!
Доказать протекание прямой и обратной реакций после достижения равновесия можно множеством способов. Так, если в равновесную смесь водорода, азота и аммиака ввести немного изотопа водорода — дейтерия, то чувствительный анализ сразу обнаружит присутствие дейтерия в молекулах аммиака. И наоборот, если ввести в систему немного дейтерированного аммиака NH2D, дейтерий тут же появится в молекулах исходного вещества в виде HD и D2.
Простой, но весьма эффектный опыт провёл сотрудник химического факультета МГУ В. С. Гурман в 50-х гг. XX в. Он помешал серебряную пластинку в раствор нитрата серебра, при этом, как и следовало ожидать, никаких изменений не наблюдалось. Затем в раствор вводилось ничтожно малое количество AgNO3, содержащего радиоактивные атомы серебра. И серебряная пластинка становилась радиоактивной! Ни споласкивание её водой, ни промывание соляной кислотой радиоактивность не «смывали», помогали только травление азотной кислотой или механическая обработка поверхности мелкой наждачной бумагой. Объяснить результат эксперимента можно единственным образом: между металлом и раствором непрерывно происходит обмен атомами серебра, т. е. в системе идёт обратимая реакция Ag (тв)-e«Ag+ (раств). Поэтому при добавлении радиоактивных ионов Ag+ к раствору они «внедрялись» и в пластинку в виде нейтральных, но по-прежнему радиоактивных атомов.
Таким образом, равновесными бывают не только химические реакции между газами или растворами, но и процессы растворения металлов, осадков. Например, твёрдое вещество быстрее всего растворяется, когда его помешают в чистый
растворитель, т. е. когда система далека от
равновесия, в данном случае — от насыщенного раствора. Постепенно скорость растворения снижается, и одновременно увеличивается скорость обратного процесса — перехода вещества из раствора в кристаллический осадок. Наконец раствор становится насыщенным, и система достигает состояния равновесия: теперь скорости растворения и кристаллизации равны, а масса осадка со временем не меняется.
(продукты С и D ещё не образовались), постепенно увеличивается. Рано или поздно наступит момент, когда скорости обеих реакций сравняются. После этого концентрации всех веществ — А, В, С и D — не будут изменяться со временем (такие концентрации называются равновесными). Это значит, что реакция достигла положения равновесия. Но в отличие от механического равновесия, при котором всякое движение прекращается, при химическом равнове-

Между осадком вещества и его насыщенным раствором существует химическое равновесие: часть вещества из осадка непрерывно переходит в раствор, а из раствора — в осадок. Количество осаждённого вещества и концентрация раствора при этом не меняются.
сии обе реакции — и прямая, и обратная — продолжают идти. Просто скорости их равны, и потому кажется, что никаких изменений в системе не происходит.
Важнейший параметр, характеризующий обратимую химическую реакцию, — константа равновесия Кравн. Запишем для реакции А+В«C+D (предполагается, что она элементарная) условие равенства скоростей прямой и обратной реакций в состоянии равновесия:

Итак, при равновесии отношение произведения концентраций продуктов реакции к произведению концентраций реагентов постоянно, если постоянна температура (поскольку константы скорости k1 и k2 и, следовательно, константа равновесия Кравн зависят от температуры).
Если в реакции участвуют несколько молекул исходных веществ и образуется несколько молекул продукта (или продуктов), концентрации веществ в выражении для константы равновесия (но не констант скорости!) возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так, для реакции ЗН2+N2«2NH3 выражение для константы равновесия записывается в виде
Kpaвн=[NH3]2paвн/[H2]3paвн[N2]paвн.
Константы равновесия часто считают размерными величинами. Размерность константы зависит от конкретной реакции. Например, для реакции 3Н2+N2«2NH3 размерность константы
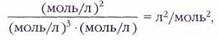
а вот для реакции Н2+I2«2HI константа равновесия не имеет размерности.
Если реагенты — газообразные соединения, то вместо концентра-
ций для записи константы равновесия обычно используют давления; очевидно, что численное значение константы при этом другое. Следует отметить, что приведённый здесь метод вывода константы равновесия, основанный на скоростях прямой и обратной реакций, применим только в случаях самых простых процессов, так как для сложных зависимость скорости от концентрации может быть неизвестна.
Большая величина Кравн означает, что числитель намного превышает знаменатель, т. е. продуктов значительно больше, чем исходных веществ. В этом случае химики говорят, что равновесие реакции сдвинуто вправо. Соответственно, при малых значениях К равн прямая реакция протекает в незначительной степени — равновесие сдвинуто влево. Введение катализатора не сдвигает положение равновесия, а только ускоряет его достижение (поскольку катализатор в равной мере ускоряет и прямую, и обратную реакцию). Графики, показывающие, как система приближается к равновесию, называются кинетическими кривыми.
Чтобы предсказать возможность протекания реакции aА+bB«сС+dD в данном направлении, необходимо определить знак изменения свободной энергии Гиббса DG (см. статью «Быть или не быть реакции? Химическая термодинамика»). В курсе физической химии выводится уравнение, связывающее DG со стандартным значением изменения энергии Гиббса (АС) и концентрациями всех реагентов:

Если DG<0, реакция пойдёт слева направо, если DG>0 — справа налево, а при достижении равновесия DG=0. В последнем случае формулу можно переписать в виде DG0=-RTlnKравн. Это позволяет без проведения многочисленных и сложных экспериментов вычислять значения Кравн для разнообразных химических реакций и, соответственно, рассчитывать равновесные концентрации исходных веществ и продуктов.

Кинетические кривые:
1 — если k1<k2,
то К равн<1, равновесие сдвинуто в сторону исходных веществ;
2 — если k1>k2,
То К равн>1, равновесие сдвинуто в сторону продуктов реакции. Пунктиром показано приближение к равновесию в присутствии катализатора.
В редком случае, когда k1=k2
Kравн=1), кинетические кривые для исходных веществ и продуктов сольются.
Возможность подобных расчётов стала важнейшим успехом химической термодинамики.
ПРИНЦИП ЛЕ ШАТЕЛЬЕ
В 1884 г. французский физикохимик и металловед Анри Луи Ле Шателье (1850—1936) сформулировал общий принцип смещения химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Система как бы стремится противостоять изменению внешних условий. Когда, например, температуру равновесной смеси повышают, сама система, конечно, не может ослабить внешний нагрев. Однако равновесие в системе смещается таким образом, что для нагревания её до определённой температуры требуется уже большее количество теплоты. А именно: сдвиг равновесия идёт в сторону эндотермической реакции (протекающей с поглощением теплоты).
Если в левой и правой частях уравнения имеется неодинаковое число молекул газообразных веществ, то равновесие в такой системе можно сместить и путём изменения давления. (Это происходит даже

Анри Луи Ле Шателье.
Константы равновесия определены для очень многих реакций. В большинстве случаев известно и то, как изменяется величина Кравн в зависимости от… Кравн = [СН3СОО-]равн[Н+]равн/(с0 - [H+]равн) = [Н+]2равн/(с0 - [H+]равн). Решая это квадратное уравнение (и опуская для простоты обозначение «равн»), получаем два решения:– Конец работы –
Используемые теги: вещество, Электричество0.047
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ВЕЩЕСТВО И ЭЛЕКТРИЧЕСТВО
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов