Соотношение между энергией активации и температурой, при котором выполняется правило Вант-Гоффа.
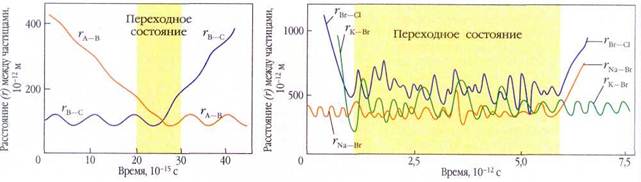
В простейшей модели химической реакции атомные ядра представляют твёрдыми шариками, которые движутся по законам классической механики. Химики, изучая «шаг за шагом» сближение и взаимодействие молекул, могут изобразить на бумаге или воссоздать на экране компьютера некую особую поверхность, называемую поверхностью потенциальной энергии, которая отражает зависимость общей энергии взаимодействия всех ядер и электронов химической системы от всех межъядерных расстояний. Минимумы на поверхности соответствуют устойчивым состояниям реагентов и продуктов реакции, а область вблизи максимума (точки перевала) — переходному состоянию. Разность между максимумом и энергией исходных веществ — это энергия активации прямой реакции. Разность между максимумом и энергией продуктов —
энергия активации обратной реакции. Разность между энергиями исходных веществ и продуктов равна тепловому эффекту реакции.
Поверхности потенциальной энергии обычно многомерны, т. е. зависят от многих переменных, поэтому их трудно представить наглядно. Исключение — случай линейного столкновения атома и двухатомной молекулы:
X+YZ®XY+Z,
когда энергия зависит только от двух межъядерных расстояний: X—Y и Y—Z. Для такой реакции поверхность потенциальной энергии имеет достаточно простой вид. Дня химической кинетики важна не вся энергетическая поверхность, а лишь небольшой её участок вблизи наиболее вероятной траектории изменения энергии ядер. Эту траекторию называют координатой химической реакции.
стью. Если реакция имела небольшую энергию активации и шла слишком быстро, для её замедления температуру понижали. Если же, наоборот, надо было изучить скорость реакции с высокой энергией активации, температуру повышали, чтобы реакцию ускорить до «удобного» значения. В обоих случаях как бы сами собой получались определённые соотношения между энергией активации и температурой — такие, при которых выполняется правило Вант-Гоффа.
Эти соотношения наглядно представлены на графике: значения энергии активации и температуры, соответствующие правилу Вант-Гоффа, располагаются между двумя ветвями параболы. Если для какой-либо реакции они окажутся под нижней ветвью, такая реакция будет ускоряться меньше чем в 2 раза при повышении температуры на 10 °С, а если над верхней — реакция ускорится более чем в 3 раза.
В настоящее время экспериментальная техника позволяет изучать как исключительно быстрые, так и очень медленные химические реакции, для которых температурный коэффициент может быть и намного меньше 2, и значительно больше 3. Поэтому правило Вант-Гоффа современным химикам не нужно.
НЕОБЫЧНАЯ ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ
Некоторые реакции проявляют аномальные температурные эффекты. Например, скорость биохимических реакций, катализируемых ферментами, зависит от температуры следующим образом. Вплоть до некоторой критической температуры скорость ферментативной реакции увеличивается в соответствии с уравнением Аррениуса, а затем происходит денатурация фермента (нарушение его природной конфигурации), он теряет каталитические свойства, и скорость реакции уменьшается. Это приводит, в частности, к тому, что у больных людей при высокой температуре биохимические процессы в организме протекают не так, как при нормальной.
Существуют и реакции, скорость которых уменьшается при нагревании. Так, реакция 2NO+О2=2NO2 протекает в две стадии, первая из которых обратима: 2NO«(NO)2; (NO)2+O2 ®2NO,. Константа скорости второй реакции, как это обычно и бывает, увеличивается с ростом температуры. Но вот концентрация продукта первой реакции — димера (NO)2 — при нагревании падает. Концентрация димера уменьшается быстрее, чем константа скорости второй реакции, поэтому суммарная скорость всего процесса при нагревании уменьшается.