Анри Луи Ле Шателье.
РАССЧИТЫВАЕМ КОНЦЕНТРАЦИЮ КИСЛОТЫ
Константы равновесия определены для очень многих реакций. В большинстве случаев известно и то, как изменяется величина Кравн в зависимости от температуры. Располагая значением константы равновесия при данной температуре и зная, сколько каких веществ имеется в начальный момент, можно рассчитать концентрации всех компонентов равновесной смеси. В качестве примера рассмотрим реакцию диссоциации в растворе уксусной кислоты: СН3СООН «СН3СОО-+Н+. Пусть с0 — исходная концентрация кислоты. Очевидно, что при равновесии (здесь оно достигается исключительно быстро) [СН3СООН]равн=с0-[Н+]равн и [СН3СОО]равн=[Н+]. Тогда для константы равновесия можно записать уравнение
Кравн = [СН3СОО-]равн[Н+]равн/(с0 - [H+]равн) = [Н+]2равн/(с0 - [H+]равн).
Решая это квадратное уравнение (и опуская для простоты обозначение «равн»), получаем два решения:
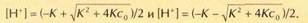
Выбираем первое, поскольку очевидно, что второе решение не имеет физического смысла: концентрация не может быть отрицательной величиной.
Уксусная кислота относится к слабым кислотам; при комнатной температуре для реакции её диссоциации Кравн=1,75•10-5, т. е. равновесие сдвинуто влево — в сторону недиссоциированных молекул. Поэтому выведенную формулу для расчёта концентрации ионов водорода можно заметно упростить. Действительно, для малых К концентрация молекул кислоты при диссоциации практически не уменьшается, так что с0=[Н+]. При этом выражение для константы равновесия
запишется в виде К = [Н+]2/с0, откуда

Например, если концентрация уксусной кислоты равна 1 моль/л,
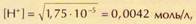
т. е. продиссоциировала очень малая часть молекул. С разбавлением кислоты разница между её концентрацией и концентрацией ионов водорода становится не такой большой. Так, при с0=0,01 моль/л
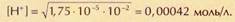
Формулы для константы равновесия сложных реакций оказываются значительно более громоздкими, причём из них не всегда можно вывести аналитические выражения для расчёта концентраций (например, если получается уравнение пятой степени). Тем не менее расчёт концентраций при использовании компьютерных программ не представляет каких-либо трудностей.
при неизменной константе равновесия, которая зависит только от температуры.) При повышении давления равновесие смещается в ту сторону, где число молекул газов меньше (и таким способом система «противодействует» внешнему давлению); при понижении давления равновесие
смещается в обратную сторону. Когда число молекул газов в ходе реакции не меняется, давление не будет влиять на положение равновесия. В качестве примера можно привести реакции Н2+Вr2(г) «2НВr; СО+Н2О(г) «СО2+Н2 и др. Для рассмотренной ранее реакции синтеза аммиака повышение давления смещает равновесие в сторону меньшего числа молекул, т. е. в сторону NН3.
Пример противоположного влияния температуры и давления на положение равновесия — промышленная реакция дегидрирования (отщепления водорода) циклогексана с образованием бензола: С6Н12 «С6Н6+3Н2. Её проводят в газовой фазе в присутствии катализатора.
Реакция идёт с затратой энергии (т. е. она эндотермическая), но с увеличением числа молекул. Поэтому влияние температуры и давления на неё будет прямо противоположным тому, которое наблюдается в случае синтеза аммиака. То есть увеличению равновесной концентрации бензола в смеси способствует повышение температуры и понижение давления, Вот почему в промышленности реакцию проводят при невысоких давлениях (2—3 атм) и высоких температурах (450—500 °С). Здесь повышение температуры «дважды благоприятно»: оно не только ускоряет процесс, но и способствует сдвигу равновесия в сторону образования необходимого продукта.
Конечно, ещё большее снижение давления (например, до 0,1 атм) вызвало бы дальнейшее смещение равновесия вправо. Однако при этом в реакторе будет находиться слишком мало вещества, а значит, уменьшится и скорость реакции, так что общая производительность не повысится, а понизится.
Этот пример ещё раз показывает, что экономически обоснованный синтез — это удачное лавирование «между Сциллой и Харибдой».
Ярким подтверждением принципа Ле Шателье являются многочисленные экспериментальные данные. Некоторые примеры указаны в приведённой таблице.

Видно, что для одних реакций (экзотермических) значение Кравн с ростом температуры уменьшается; для других (эндотермических) — увеличивается.