Первое начало термодинамики. Теплоемкость ИГ. Работа газа при изменении его объема
Первое начало термодинамики:
Количество теплоты, сообщённое газу, идёт на приращение внутренней энергии газа и на совершенигазом работы над внешними телами.
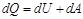 - первое начало термодинамики
- первое начало термодинамики
а) Внутренняя энергия идеального газа равна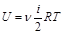 , где
, где 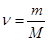 - количество вещества, i – число степеней свободы молекул газа, R – универсальная газовая постоянная, Т – термодинамическая температура. Тогда
- количество вещества, i – число степеней свободы молекул газа, R – универсальная газовая постоянная, Т – термодинамическая температура. Тогда 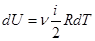 - изменение внутренней энергии газа. (1.2)
- изменение внутренней энергии газа. (1.2)
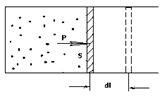 б) Вычислим работу, совершаемую газом при изменении объёма. Для этого рассмотрим газ, находящийся в цилиндре под поршнем, который может свободно перемещаться. При нагревании давление газа P , будет оставаться постоянным, и, как видно из рисунка, работа, которую совершает газ, будет равна:
б) Вычислим работу, совершаемую газом при изменении объёма. Для этого рассмотрим газ, находящийся в цилиндре под поршнем, который может свободно перемещаться. При нагревании давление газа P , будет оставаться постоянным, и, как видно из рисунка, работа, которую совершает газ, будет равна: 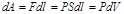 ,где dV = S dl - изменение объема газа.
,где dV = S dl - изменение объема газа. 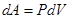 – работа, совершаемая газом при изменении его объема. (1.3)
– работа, совершаемая газом при изменении его объема. (1.3)
в) Найдём формулу для подсчёта количества теплоты, сообщенной газу массы m при его нагревании на dT. Для этого введем понятие молярной теплоёмкости газа: 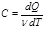
Молярная теплоёмкость газа – это количество теплоты, сообщённой одному молю газа, для увеличения его температуры на один градус Кельвина.
Тогда формула для подсчёта теплоты будет иметь вид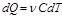 - теплота, сообщённая газу для
- теплота, сообщённая газу для
увеличения его температуры на dT. 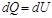 -первое начало термодинамики для изохорического процесса.
-первое начало термодинамики для изохорического процесса. 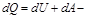 первое начало термодинамики для изобарического процесса. dQ = dA - первое начало термодинамики при изотермическом процессе
первое начало термодинамики для изобарического процесса. dQ = dA - первое начало термодинамики при изотермическом процессе
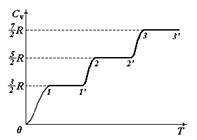
Теплоемкость идеального газа
Согласно рассмотренной нами теории теплоемкости Cv и Cp газов должны быть целыми числами, кратными R/2, поскольку число степеней свободы может быть только целым. Поэтому даже малые расхождения между теоретическими и экспериментальными значениями Cv и Cp играют принципиальную роль. Такое расхождение можно обнаружить, если обратится к температурной зависимости теплоемкости газа. На рис. 1.8 изображена кривая зависимости молярной теплоемкости Cv от температуры Т, полученная опытным путем для водорода. Согласно теории теплоемкость не должна зависеть от температуры. Из рисунка 1.8 видно, что это оказывается справедливым только в пределах отдельных температурных интервалов, причем в различных интервалах теплоемкость имеет значения, соответствующие различному числу степеней свободы молекулы. Так, на участке 1 – 1’ Cv равно 3/2 R. Это означает, что молекула ведет себя, как система, обладающая только поступательными степенями свободы. На участке 2 – 2’ Cv равно 5/2 R. Следовательно, при температурах, соответствующих этому участку, у молекулы, в дополнение к проявившимся при более низких температурах трем поступательным степеням свободы, добавляются еще две вращательные. Наконец, при достаточно больших температурах (Т > 1000 К) теплоемкость Cv становится равной 7/2 R , что свидетельствует о наличии при этих температурах колебаний молекулы. В промежутках между указанными интервалами теплоемкость монотонно растет с температурой.
Объяснение такого поведения теплоемкости дается квантовой механикой. Как устанавливает квантовая теория, энергия вращательного и колебательного движений молекул оказывается квантованной. Это означает, что энергия вращения и энергия колебания молекулы могут иметь не любые значения, а только дискретные (т.е. отдельные, отличающиеся друг от друга на конечную величину) значения. Следовательно, энергия, связанная с этими видами движения, может меняться только скачками. Для энергии поступательного движения такого ограничения не существует.
Интервалы между колебательными уровнями энергии примерно в десять раз больше, чем между вращательными. Этим и объясняется тот факт, что при низких температурах молекулы участвуют только в поступательном движении, и Cv = 3/2 R. При повышении температуры наступает такой момент, когда молекулы вовлекаются во вращательное движение, и Cv = 5/2 R. Наконец, при дальнейшем повышении температуры (Т > 1000 К) молекулы будут участвовать также и в колебательном движении, и Cv = 7/2 R. Участки кривой 1’– 2 , 2’ – 3 означают, что не все молекулы сразу вовлекаются во вращательное (участок 1’– 2) движение, а также в колебательное (участок 2’– 3) движение.
Таким образом, классическая теория теплоемкости приблизительно верна лишь для отдельных температурных интервалов, причем каждому интервалу соответствует свое число степеней свободы молекулы.
Газ оказывает давление на любую стенку сосуда. Если стенка подвижна (например, поршень на рис. 1), то сила давления F совершит работу A, переместив поршень на расстояние DL. Если DL невелико, то давление газа останется примерно постоянным. Тогда работа будет равна:A = F•DL•cosa = P•S•DL, где S –площадь поршня, a - угол между направлением силы и перемещением поршня (a = 0). Произведение S•DL равно изменению объема газа DV от начального V1 до конечного V2значения, т.е. S•DL =DV = V1 - V2. Тогда A = P•(V2 - V1) = P•DV.В изобарном процессе расширения газа P = const. Следовательно, при любом сколь угодно большом увеличении объема сила давления газа на поршень будет постоянной, и формула работы сохранит свой вид A = P•(V2 - V1).Как видно из рисунка 2, работа газа при изобарном расширении равна площади под графиком процесса в координатах P, V. Если в процессе расширения давление газа изменяется, то для вычисления работы можно воспользоваться графическим методом (см. рис. 3). Пусть процесс расширения имеет вид, изображенный на рисунке. При любом малом изменении объема DV работа равна площади малого прямоугольника (на рис. 3 он заштрихован). Полная работа равна сумме площадей всех малых прямоугольников и равна площади фигуры, ограниченной линией, представляющей собой график процесса.
При сжатии газа внешними силами перемещение поршня DL противоположно силе давления газа F, тогда работа газа будет отрицательной величиной (DV < 0). Работа внешней силы A' в данном случае будет положительной, а величина A' = - A.