Термодинамика изохорического процесса: V=const.
Рассмотрим закон, описывающий этот процесс, и его график в координатах (P,V). Этот закон является частным случаем уравнения Менделеева-Клапейрона (уравнения состояния идеального газа) 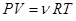 . Запишем это уравнение для состояний газа 1 и 2 и, разделив одно на другое, получим:
. Запишем это уравнение для состояний газа 1 и 2 и, разделив одно на другое, получим:
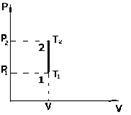
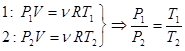 . - закон Шарля.
. - закон Шарля.
График изохорического процесса в координатах (P,V) представлен на рис. 1.2.
Так как 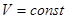 , то
, то 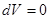 и
и 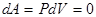 , т.е.
, т.е.  - работа, совершаемая газом при изохорическом процессе, равна нулю.
- работа, совершаемая газом при изохорическом процессе, равна нулю.
Тогда
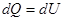 - первое начало термодинамики для
- первое начало термодинамики для
изохорического процесса.
Поскольку количество теплоты, сообщенное газу, равно
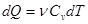 ,
,
где 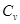 - молярная теплоёмкость газа при постоянном объёме, то мы получаем полезную формулу для подсчёта приращения внутренней энергии газа:
- молярная теплоёмкость газа при постоянном объёме, то мы получаем полезную формулу для подсчёта приращения внутренней энергии газа:
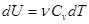 - изменение внутренней энергии газа. (1.6)
- изменение внутренней энергии газа. (1.6)
Сравнивая формулы (1.2) и (1.6), получим выражение для молярной теплоёмкости газа при постоянном объёме:
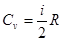 .
.
№ 44 Термодинамика изобарического процесса: P=const. Соотношение Майера.
Рассмотрим закон, описывающий этот процесс, и его график в координатах (P,V). Запишем уравнение состояния идеального газа для состояний 1 и 2 и, разделив одно уравнение на другое, получим:
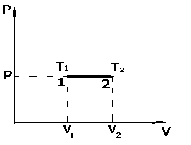 Рис. 1.3. График изобарического процесса (изобара)
Рис. 1.3. График изобарического процесса (изобара)
|
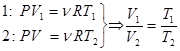 - закон Гей-Люссака.
- закон Гей-Люссака.
График изобарического процесса в координатах (P,V) представлен на рис. 1.3.
Работа, совершаемая газом, 
приращение внутренней энергии газа также не равно нулю  , и первое начало термодинамики сохраняет вид (1.1):
, и первое начало термодинамики сохраняет вид (1.1):
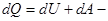 первое начало термодинамики для
первое начало термодинамики для
изобарического процесса.
Формула для подсчёта теплоты при изобарическом процессе принимает вид:
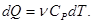
где 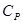 - молярная теплоёмкость газа при постоянном давлении.
- молярная теплоёмкость газа при постоянном давлении.
Воспользовавшись уравнением Менделеева-Клапейрона, представим работу, совершаемую газом, в следующем виде:
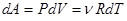 .
.
Из выражения для работы следует размерность и физический смысл универсальной газовой постоянной R:
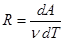 ,
, 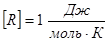 .
.
Универсальная газовая постоянная R численно равно работе, совершённой одним молем газа при изобарическом процессе при увеличении его температуры на один градус Кельвина.
Подставим выражения для dQ, dU (1.6), dA в первое начало термодинамики:
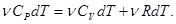
Сокращая на ndT, получим соотношение между молярными теплоёмкостями газа при постоянном объёме 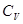 и постоянном давлении
и постоянном давлении 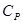 :
:
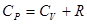 - соотношение Майера. (1.8)
- соотношение Майера. (1.8)
Учитывая, что 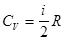 , выражение для
, выражение для 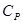 будет иметь вид:
будет иметь вид:
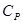 =
=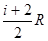 . (1.9)
. (1.9)
Приведем также выражение для отношения молярных теплоёмкостей 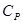 и
и 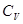 :
:
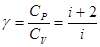 .
.
Например, для двухатомных молекул при невысоких температурах i = 5, тогда  1,4.
1,4.
Вычислим работу, совершаемую газом при изобарическом процессе:
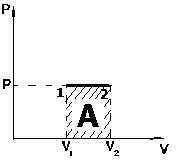 Рис. 1.4. Работа при изобарическом процессе
Рис. 1.4. Работа при изобарическом процессе
|
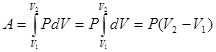 , т.е.
, т.е.
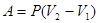 - работа, совершаемая газом при
- работа, совершаемая газом при
изобарическом процессе.
На графике изобарического процесса в координатах (P,V) работа, совершаемая газом, численно равна площади прямоугольника, построенного под изобарой (рис. 1.4).