Второе начало термодинамики. Цикл Карно
Второе начало термодинамики:Невозможно построить периодически действующую тепловую машину, которая бы всю подводимую к ней теплоту превращала в работу, т.е. всегда 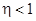 .
.
Французский инженер Сади Карно предложил идеальный цикл, который даёт максимальное значение КПД. Этот цикл состоит из двух изотерм и двух адиабат и носит название цикла Карно.
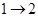 - изотермическое расширение
при - изотермическое расширение
при 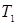 , ,
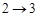 - адиабатическое расширение - адиабатическое расширение
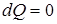 , ,
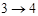 - изотермическое сжатие
при - изотермическое сжатие
при 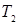 , ,
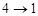 - адиабатическое сжатие - адиабатическое сжатие
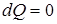 . .
|
 Рис. 2.2 Цикл Карно в координатах (P, V).
Рис. 2.2 Цикл Карно в координатах (P, V).
Вычислим КПД цикла Карно для идеального газа. При изотермическом процессе внутренняя энергия идеального газа остаётся постоянной. Поэтому количество полученной газом теплоты 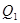 равно работе
равно работе 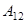 , совершаемой газом при переходе из состояния 1 в состояние 2 (рис. 2.2). Эта работа равна
, совершаемой газом при переходе из состояния 1 в состояние 2 (рис. 2.2). Эта работа равна 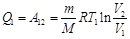 где
где 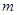 – масса идеального газа в тепловой машине.
– масса идеального газа в тепловой машине.
Количество отдаваемой холодильнику теплоты 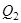 равно работе
равно работе 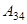 , затраченной на сжатие газа при переходе его из состояния 3 в состояние 4. Эта работа равна
, затраченной на сжатие газа при переходе его из состояния 3 в состояние 4. Эта работа равна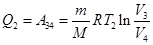 .
.
Для того, чтобы цикл был замкнутым, состояние 1 и 4 должны лежать на одной и той же адиабате. Отсюда вытекает условие:
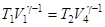 .
.
Аналогично для состояний 2 и 3 справедливо условие:
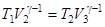 .
.
Разделив одно соотношение на другое, приходим к условию замкнутости цикла:
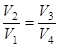 .
.
Подставляя 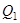 и
и 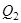 в выражение для КПД, получим:
в выражение для КПД, получим:
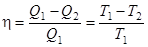 . (2.2)
. (2.2)
В результате получим формулу для КПД цикла Карно:
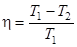 ,
,
где 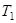 - температура нагревателя,
- температура нагревателя, 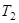 - температура холодильника. КПД цикла Карно является максимальным КПД из всех возможных циклов, осуществляемых в данных температурных интервалах
- температура холодильника. КПД цикла Карно является максимальным КПД из всех возможных циклов, осуществляемых в данных температурных интервалах 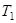 и
и 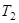 .
.
Соотношение (2.2) составляет содержание теоремы Карно для обратимого цикла:
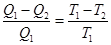 .
.
Для необратимого цикла теорема Карно принимает вид:
 .
.
В общем случае можно объединить эти две записи теоремы Карно:
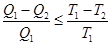 . (2.3)
. (2.3)
Преобразуем (2.3) следующим образом:
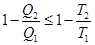 ,
, 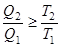 , или
, или 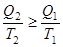
В результате получим
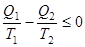 .
.
Для обратимого цикла Карно: 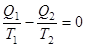 ,
,
для необратимого цикла Карно: 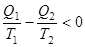 .
.
Тогда в случае произвольного обратимого цикла можно получить:
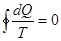 , (2.4)
, (2.4)
а в случае произвольного необратимого цикла:
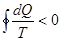 .
.
Соотношение (2.4) показывает, что величина, стоящая под знаком интеграла, является функцией состояния. Эта функция состояния обозначается буквой S и называется энтропией. Наряду с внутренней энергией U энтропия S играет важную роль в термодинамике.