Химическое выветривание
Главными факторами химического выветривания являются вода, кислород, углекислота и органические кислоты.
Под их влиянием существенно изменяются структура и вещественный состав горных пород и образуются новые минералы, которые оказываются устойчивыми в поверхностных или гипергенных условиях.
В химическом выветривании принимают участие и органические кислоты, выделяемые растительностью и микроорганизмами. И, следовательно, в данном типе выветривания принимают участие и биохимические процессы.
Важнейшим фактором химического и биохимического выветривания является вода, которая не только растворяет химические элементы и соединения, находящиеся в горной породе, но и обусловливает миграцию наиболее подвижных химических соединений.
Окисление

 H2O H+ + OH-
H2O H+ + OH-
Диссоциация воды
Ионы H+ способны извлекать и удалять из кристаллов различные ионы.
Скорость воздействия на горные породы во время химического выветривания возрастает в том случае, когда в растворе присутствуют углекислота и органические кислоты.
Химическое воздействие на минералы и горные породы оказывают находящиеся в растворенном в воде виде такие ионы, как НСО3-, SO2-, Ca2+, Mg2+, Na+, К+ и др. Они замещают заряженные атомы в кристаллах или взаимодействуют с ними, тем самым нарушая единство кристаллической решетки.
Процессы химического выветривания последовательно происходят в следующих основных химических реакциях: окислении, гидратации, растворении и гидролизе.
Этот процесс наиболее интенсивно протекает в горных породах, содержащих минералы, состоящие из соединений железа(III), марганца.
Например, при окислении магнетит переходит в более устойчивую форму — гематит:
 Fe3O4 Fe2O3
Fe3O4 Fe2O3
Сульфиды в кислой среде становятся неустойчивыми и постепенно замещаются сульфатами, оксидами и гидроксидами.

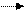
 FeS2 +nО2 + nН2О Fe3O4 Fe2(SO4)2 Fe2O3· nH2О
FeS2 +nО2 + nН2О Fe3O4 Fe2(SO4)2 Fe2O3· nH2О
пирит лимонит
Бурый железняк (лимонит) – это сложный полиминеральный агрегат, состоящий из гётита (FeO · ОН) и гидрогётита (FeO · ОН · nН2О).
Устойчивый в поверхностных условиях гематит возникает и при выветривании таких минералов, как оливин, пироксены, амфиболы под действием воды, кислорода и углекислоты.
Реакция такого преобразования может быть изображена следующим образом:

 (Mg,Fe)2(Si04) Fe2O3 + nMg(HCO3)2 + nH4Si04
(Mg,Fe)2(Si04) Fe2O3 + nMg(HCO3)2 + nH4Si04
оливин гематит растворимые соединения
В результате процесса преобразования железосодержащих минералов и их перехода в лимонит многие горные породы, в частности пески, песчаники, глины, мергели, окрашиваются в бурый или охристый цвет, что свидетельствует об окислении включений, содержащих железистые минералы.
Гидратация
Данный процесс заключается в присоединении воды к веществу. В результате этого осуществляется закрепление молекул воды на поверхности некоторых участков кристаллической решетки.
Примером гидратации является переход ангидрита в гипс:

 CaSO4 + 2Н2О CaSO4·2H2O
CaSO4 + 2Н2О CaSO4·2H2O
ангидрит гипс
При изменении условий реакция обратима и гидратация превращается в дегидратацию.
 Процесс гидратации происходит при переходе гематита в гидроксиды железа. Fe2O3 + H2O 2 FeO (OH)
Процесс гидратации происходит при переходе гематита в гидроксиды железа. Fe2O3 + H2O 2 FeO (OH)
гематит гётит
Далее гётит переходит в гидрогётит.
 FeO (OH) + nН2О FeO · nН2О
FeO (OH) + nН2О FeO · nН2О
гётит гидрогётит
Растворение
Горные породы растворяются водами, содержащими углекислоту или органические кислоты.
Особенно интенсивно этот процесс проявляется в осадочных горных породах, которые представлены хлоридами, сульфатами и карбонатами.
Наибольшей растворимостью обладают хлориды — соли натрия (галит или поваренная соль) и калия (сильвин).
Далее по степени растворимости следуют сульфаты — ангидрит и гипс, затем карбонаты — известняки и доломиты. В процессе растворения среди монолитных толщ осадочных пород возникают различные полости, создающие карстовые формы рельефа.
Гидролиз
Сущность этого процесса заключается в разложении минералов и выносе отдельных элементов и соединений и присоединении к оставшимся соединениям гидроксильных ионов и гидратации.
При этом существенным образом нарушается структура кристаллов, которая заменяется совершенно новой.
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH



 2Na + + CO32 − + H+ + OH− = Na + + HCO3− + Na + + OH−
2Na + + CO32 − + H+ + OH− = Na + + HCO3− + Na + + OH−
CO32− + H2O = HCO3− + OH−
(раствор имеет щелочную реакцию, реакция протекает обратимо)
2. Гидролиз соли сильной кислоты и слабого основания:
CuCl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую реакцию, реакция протекает обратимо)
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
2Al3+ + 3S2− + 6Н2О = 2Al(OH)3 + ЗН2S
(Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
4. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
В гипергенных условиях каркасная структура полевых шпатов превращается в слоевую, которая характерна для различных глинистых минералов.
Из кристаллической решетки полевых шпатов выносятся ионы калия, натрия и кальция (в виде К2СО3, Na2CO3, CaHCO3, СаСО3) в результате их взаимодействия с углекислотой.
Процесс идет в условиях влажного и жаркого климата.
Если климат сухой, то карбонаты остаются в глинах.
Стадии разложения полевых шпатов в условиях влажного теплого климата. В этих условиях полевые шпаты вначале переходят в гидрослюду, а затем в более устойчивый в гипергенных условиях глинистый минерал каолинит:




 K(AlSi3O8) (K,H2O)Al2(OH)2(AlSi4O10)·nН2О Al4(OH)8(Si4O10)
K(AlSi3O8) (K,H2O)Al2(OH)2(AlSi4O10)·nН2О Al4(OH)8(Si4O10)
ортоклаз гидрослюда каолинит
Судьба кремнезема в этом процессе:
SiO2 выносится в форме истинных растворов или комплексных кремнийорганических соединений (соединения, в которых Si связан с углеродом, как, например, в силанах: (CH3)4Si, CH3SiH2SiH2CH3, (CH3)3SiCl.

Структурная формула силана

Структурная формула силикона (кислородсодержащее кремнийорганическое соединение.
Значительная часть кремнезема в водах сравнительно быстро переходит в коллоидальное (от греч. «колла» — клей) состояние и выпадает из раствора в виде амофного гидратированного осадка SiO2·nН2О.
Это аморфный минерал при высыхании и частичной потере воды превращается в опал. Но часть кремнезема остается в связанном состоянии в каолинитовой молекуле.
[Опал – аморфный диоксид кремния SiO2·nH2O Формы выделения: гроздьевидные или почковидные агрегаты аморфного кремнезёма, выполнение трещин. По происхождению осадочный, гипергенный или низкотемпературно-гидротермальный. Встречается в виде прожилок, заполняя трещины вмещающих пород].
В условиях влажного тропического и экваториального климата при большом количестве атмосферных осадков, высоких среднегодовых температурах и большом растительном опаде выветривание горных пород на каолинитовой стадии не прекращается и происходит дальнейшее разложение каолинитовой молекулы до свободных оксидов и гидроксидов:
 Al4(OH)8(Si4O10) Аl(ОН)3 + SiO2·nН2О
Al4(OH)8(Si4O10) Аl(ОН)3 + SiO2·nН2О


 каолинит гидраргиллит опал
каолинит гидраргиллит опал
Гидраргиллит - Аl(ОН)3 - или гиббсит — один из главных рудоносных минералов, представляющих алюминиевую руду.
Непосредственно над материнскими выветрелыми породами располагаются латериты, главной составной частью которых являются полуторные оксиды алюминия и железа (А12О3 и Fe2O3) с небольшой примесью кремнезема (SiO2).
Переотложенные и преобразованные латериты называют бокситами.
[Латерит - своеобразная красноцветная горная порода, образуется в результате выветривания алюмосиликатов в условиях жаркого и влажного климата в зонах переменно влажных субэкваториальных, тропических и частично субтропических географических поясов. Латерит — сильнопористая твердая кора выветривания, состоящая из каолина, окислов железа, алюминия].