Расчетные зависимости
Подобно тому, как состояние электрона задается набором четырех квантовых чисел: n, l, m, ms, состояние атома задается набором следующих квантовых чисел: L, S, J, mJ. Здесь L – орбитальное квантовое число атома, определяющее полный орбитальный момент импульса атома ll соотношением
 .
.
Это квантовое число принято обозначать буквами следующим образом:
L = 0, 1, 2, 3, 4, ...
S ,P, D, F, G,…
S – спиновое квантовое число атома (квантовое число S не следует путать с условным обозначением S (L = 0)). Оно определяет полный спиновый момент импульса всего атома
 .
.
J – квантовое число, определяющее полный момент импульса атома,

 .
.
mJ – магнитное квантовое число атома, определяющее проекцию момента импульса атома на физически выделенное направление,
ljz =  .
.
При заданном J mJ может принимать значения
J, J-1, J-2,..., -J+2, -J+1, -J.
При отсутствии внешнего поля состояния атома, характеризующиеся одинаковым набором квантовых чисел L S J, имеют одно и то же значение энергии. Это означает, что энергия этих состояний не зависит от ориентации момента импульса атома (энергия этих состояний атома не зависит от mJ). Такую совокупность состояний в атомной физике принято обозначать следующей символической записью 2S+1lj, получившей название терм атома. Например, при L = l, S = 1/2 и J = 3/2 терм атома обозначают 2P3/2. Он заключает в себя состояния со следующим набором квантовых чисел:
| L | S | J | mJ |
| ½ | 3/2 | 3/2 | |
| ½ | 3/2 | 1/2 | |
| ½ | 3/2 | -1/2 | |
| ½ | 3/2 | -3/2 |
Поскольку механические орбитальные 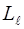 и спиновые Ls моменты импульса электрона, которые определяются соотношениями:
и спиновые Ls моменты импульса электрона, которые определяются соотношениями: 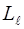 = =
= = и Ls =
и Ls = , связаны с соответствующими магнитными моментами электронов, между моментами импульсов, а, следовательно, и между электронами атома осуществляется взаимодействие. Выделяют два вида взаимодействия:
, связаны с соответствующими магнитными моментами электронов, между моментами импульсов, а, следовательно, и между электронами атома осуществляется взаимодействие. Выделяют два вида взаимодействия:
1. Моменты 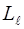 взаимодействуют между собой сильнее, чем с Ls, которые в свою очередь сильнее связаны друг с другом, чем с
взаимодействуют между собой сильнее, чем с Ls, которые в свою очередь сильнее связаны друг с другом, чем с 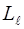 . Вследствие этого все
. Вследствие этого все 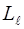 складываются в результирующий LL, a Ls складываются в LS, затем LL и LS дают результирующий общий момент импульса атома lj . Такой вид взаимодействия называют нормальным или связью LS.
складываются в результирующий LL, a Ls складываются в LS, затем LL и LS дают результирующий общий момент импульса атома lj . Такой вид взаимодействия называют нормальным или связью LS.
2. Каждая пара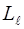 и Ls взаимодействуют между собой сильнее, чем друг с другом
и Ls взаимодействуют между собой сильнее, чем друг с другом 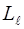 и Ls, вследствие чего образуются результирующие моменты импульса Lj для каждого электрона в отдельности, которые затем уже объединяются в lj атома. Такой вид взаимодействия называется (jj) - связью.
и Ls, вследствие чего образуются результирующие моменты импульса Lj для каждого электрона в отдельности, которые затем уже объединяются в lj атома. Такой вид взаимодействия называется (jj) - связью.
У легких атомов проявляется преимущественно нормальная связь, у тяжелых – (jj). Чтобы определить состояния, в которых может находиться атом, надо знать его электронную конфигурацию: распределение электронов по подоболочкам атома. Подоболочкой атомов называют совокупность электронов, характеризующихся одинаковым набором квантовых чисел n и  . Например, у иона Рг3+, находящегося в нормальном состоянии, электронная конфигурация следующая: 1s2 2s2 2p6 3s2 Зр6 3d10 4s2 4p6 4d10 4f2 5s2 5p6. Здесь 1s2, 2s2, 2p6 и т. д. – подоболочки атома. Правая верхняя цифра указывает, какое число электронов входит в подоболочку. Максимальное число электронов подоболочки определяется выражением: 2(2
. Например, у иона Рг3+, находящегося в нормальном состоянии, электронная конфигурация следующая: 1s2 2s2 2p6 3s2 Зр6 3d10 4s2 4p6 4d10 4f2 5s2 5p6. Здесь 1s2, 2s2, 2p6 и т. д. – подоболочки атома. Правая верхняя цифра указывает, какое число электронов входит в подоболочку. Максимальное число электронов подоболочки определяется выражением: 2(2 + l), т. е. равно числу состояний электрона при заданном наборе квантовых чисел n и
+ l), т. е. равно числу состояний электрона при заданном наборе квантовых чисел n и  .
.
Установлено, что если подоболочка атома заполнена электронами полностью, то момент импульса такой подоболочки равен нулю, т. е. моменты импульса отдельных электронов взаимно компенсируют друг друга. Электроны из заполненной подоболочки не оказывают никакого влияния на состояние атома. Состояние атома определяется только электронами незаполненной подоболочки.
Определим термы иона Рг3+, предполагая, что между электронами рассматриваемого иона проявляется преимущественно нормальная связь. Все подоболочки иона Рг3+, кроме 4f, заполнены электронами. Следовательно, состояния иона Рг3+ будут определяться только с учетом двух электронов, расположенных в подоболочке 4f. У этих электронов 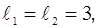
 1/2.
1/2.
Сложение двух моментов импульса осуществляется по квантовому закону, согласно которому величина орбитального момента импульса атома определяется выражением
ll=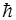
 , где L=
, где L= , т. е. L=6, 5, 4, 3, 2, 1, 0.
, т. е. L=6, 5, 4, 3, 2, 1, 0.
Сложение спиновых моментов этих электронов дает полный спиновый момент иона
Ls = , где S=s1+s2, s1+s2-1, ...,
, где S=s1+s2, s1+s2-1, ..., , т. e. S= l, 0.
, т. e. S= l, 0.
Полный момент импульса подоболочки и, следовательно, иона, может принимать следующие значения:
lj = , где J=L+S, L+S-1, ..., |L-S| при L
, где J=L+S, L+S-1, ..., |L-S| при L 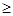 S и до S - L при S>L. Набор возможных значений квантового числа J приведен в таблице 6.1.
S и до S - L при S>L. Набор возможных значений квантового числа J приведен в таблице 6.1.
Используя приведенные значения L, S, и J для иона Рr3+, получаем следующую совокупность термов:
3I7,6,5; 3H6,5,4; 3G5,4,3; 3F4,3,2; 3D3,2,1; 3P2,1,0;
3S0; 1I6; 1H5; 1G4; 1F3; 1D2; 1S0.
Таблица 6.1
Набор значений квантового числа J
| L= | I | H | G | F | D | P | S | |
| S=1 | 7,6,5 | 6,5,4 | 5,4,3 | 4,3,2 | 3,2,1 | 2, 1,0 | J | |
| S=0 |
Однако, в соответствии с принципом Паули, не все из указанных термов могут быть реализованы. Например, ион Рr3+ не может находиться в состояниях 3I7,6,5. Действительно, L=6 означает, что орбитальные моменты импульса электронов «параллельны», следовательно, значения m у этих электронов будут совпадать. Аналогично S = 1 означает, что спины электронов также «параллельны», вследствие чего совпадают и значения ms. В итоге все четыре квантовых числа n, l, m, ms у обоих электронов оказываются одинаковыми, что недопустимо согласно принципу Паули.
Из указанных выше формально возможных термов не противоречит принципу Паули лишь следующие: 3H4,5,6; 3F2,3,4; 3P0,1,2; 1I6; 1G4; 1D2; 1S0. На рис. 6.1 приведено расположение этих уровней в энергетической схеме сво-бодных ионов Pr3+. В соответствии с принятыми в спектроскопии обозначениями энергия уровней определена в волновых числах  (точное значение энергии E = hv = hc/
(точное значение энергии E = hv = hc/ ,
,  = E/hc), где
= E/hc), где  – длина волны перехода из основного состояния 3H4 на соответствующий возбужденный уровень. На рис. 6.1 длины волн спектральных переходов приведены в ангстремах, а
– длина волны перехода из основного состояния 3H4 на соответствующий возбужденный уровень. На рис. 6.1 длины волн спектральных переходов приведены в ангстремах, а  * – в см -1.
* – в см -1.
 |
Рис. 6.1. Схема уровней иона Pr3+
На атом, входящий в состав кристаллической решетки, действует поле, созданное окружающими атомами – поле кристаллической решетки. Состояния свободного атома или иона, как правило, вырожденные; под возмущающим действием электрического поля решетки происходит расщепление уровней энергии. В данной работе используется кристалл СаF2, активированный ионами Pr3+. Структура такого кристалла изображена на рис. 6.2.
 | 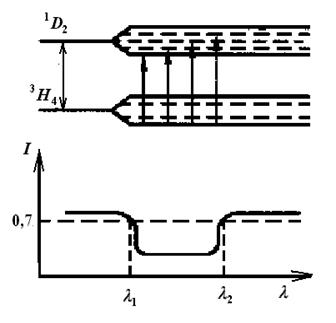 | ||
Рис. 6.2. Структура кристалла СаF2 Рис. 6.3. Штарковское расщепление уровней энергии и спектральной линии
При выращивании такого кристалла некоторые ионы Ca2+ замещаются ионами Pr3+. В этом кристалле на ион Pr3+ действует поле, созданное преимущественно ионами F– , и в меньшей степени ионами Са2+. Влияние кристаллического поля ведет к расщеплению уровней иона Pr3+, показанных на рис. 6.1 и, следовательно, к расщеплению указанных на этом рисунке спектральных линий. Четкая штарковская структура этих расщеплений может быть замечена при наблюдении спектров на приборах с большой разрешающей способностью при низких температурах (Т = 77 К). Но и при комнатной температуре (Т 300 К) спектры поглощения содержат информацию о свойствах атома. Определив ширину области (
300 К) спектры поглощения содержат информацию о свойствах атома. Определив ширину области ( ) поглощения для одного из переходов, например, 3H4 - 1D2 (рис. 6.3), по среднему значению длин волн (
) поглощения для одного из переходов, например, 3H4 - 1D2 (рис. 6.3), по среднему значению длин волн ( ) можно определить энергию возбужденного уровня 1D2, которая равна
) можно определить энергию возбужденного уровня 1D2, которая равна  . Предполагая, что исследуемые спектральные переходы возникают преимущественно в результате перехода иона только с нижнего штарковского подуровня 3Н4 на все подуровни возбужденного уровня 1D2 (рис. 6.3), можно определить ширину штарковского расщепления этого уровня
. Предполагая, что исследуемые спектральные переходы возникают преимущественно в результате перехода иона только с нижнего штарковского подуровня 3Н4 на все подуровни возбужденного уровня 1D2 (рис. 6.3), можно определить ширину штарковского расщепления этого уровня
 ,
,
где 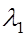 и
и  – граничные значения длин волн для выделенной полосы. При определении границы полосы поглощения
– граничные значения длин волн для выделенной полосы. При определении границы полосы поглощения  и
и  надо принять интен-сивность спектра I вблизи полосы за 1,
надо принять интен-сивность спектра I вблизи полосы за 1, 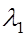 и
и  определяют при интенсивности I
определяют при интенсивности I  0,7 (см. рис. 6.3).
0,7 (см. рис. 6.3).