Лабораторная работа №3
ИЗУЧЕНИЕ ДИАГРАММЫ СОСТОЯНОИ И МИКРОСТРУКТУР
СПЛАВОВ ЖЕЛЕЗА С УГЛЕРОДОМ
Цель работы: дать студентам запас знаний по данной диаграмме, необходимый для понимания сути процессов, происходящих при кристаллизации и последующем охлаждении железоуглеродистых сплавов, а в дальнейшем – при их термообработке. Изучить классификацию железоуглеродистых сплавов по химическому составу и структуре; ознакомиться со свойствами и применением наиболее употребительных марок сталей и чугунов, изучить их микроструктуры.
3.1 Основные свойства железа
ЖЕЛЕЗО – переходный ферромагнитный металл. Порядковый номер – 26, атомная масса – 55,85, плотность – 7784 кг/м3, температура плавления – 1539 0С.
Чистое железо (99,9917%) имеет твердость по Бринеллю 490 МПа (49НВ). Технически чистое железо (99,9 – 99,8%) имеет твердость около 900 МПа; σВ = 300-350 МПа, δ = 35-40%.
Особо важным свойством железа является его аллотропия, т.е. наличие нескольких кристаллических модификаций.
Низкотемпературное α-железо (ниже 9100С) и высокотемпературное δ-железо (выше 13920С и до температуры плавления) имеют одинаковую объемно центрированную кубическую решетку (ОЦК). В интервале температур 910 – 13920С стабильным является γ-железо с гранецентрированной кубической решеткой (ГЦК). Feβ является немагнитной разновидностью Feα (при превращении α ® β в точке Кюри А2 пространственная решетка не меняется).
С металлами железо образует твердые растворы замещения, а с углеродом, азотом, бором, водородом – твердые растворы внедрения. Наиболее широкое применение в различных отраслях промышленности получили железоуглеродистые сплавы – стали и чугуны.
УГЛЕРОД – порядковый номер 6, атомная масса 12,011, имеет плотность 2300 кг/м3, температуру возгонки около 35000С, может находиться в двух аллотропических модификациях: графит и алмаз. Углерод в сплавах с железом может существовать в виде цементита (карбида железа Fe3C) и в виде графита (свободный углерод). Свободный цементит (800 НВ) является неустойчивым химическим соединением. При высокой температуре и продолжительной выдержке цемент распадается с образованием графита и аустенита. Этот процесс имеет важное практическое значение для высокоуглеродистых сплавов - чугунов. В сталях, где концентрация углерода сравнительно невысока, цементит имеет большую устойчивость.
3.2 Диаграмма фазового равновесия «железо – углерод»
Современный вариант диаграммы состояния «железо – углерод» приведен на рис. 3.1. Характерной особенностью этой диаграммы является то, что на ней нанесены две системы одновременно: система Fe – Fe3C (железо – цементит) – метастабильная – и (железо – графит) – стабильная. Большое практическое значение имеет метастабильная диаграмма, т.к. с помощью этой диаграммы объясняют превращения, происходящие в сталях и белых чугунах. Диаграмма является основой для рационального выбора оптимальных режимов термической обработки железоуглеродистых сплавов.
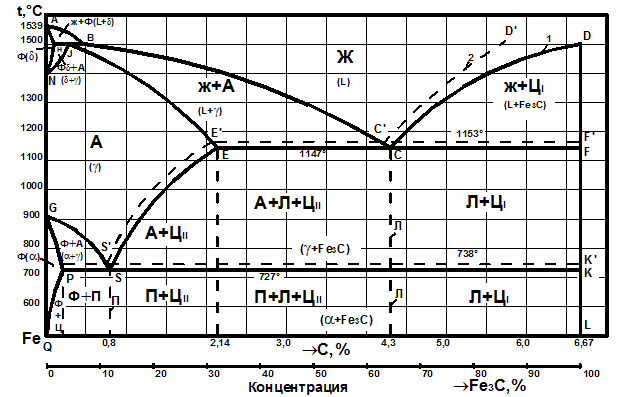
Рис. 3.1. Диаграмма состояния «железо-углерод»:
1 – метастабильная; 2 – стабильная
3.3. Основные фазы, области, линии и точки диаграммы
В сплавах системы «железо - углерод» встречаются следующие фазы:
1. Жидкий раствор.
2. Твердые растворы на основе различных кристаллических модификаций железа.
3. Химическое соединение Fe3C (цементит).
4. Структурно-свободный углерод (графит).
Жидкая фаза представляет собой неориентированный раствор Fe и С, распространяющийся выше линии ликвидус АВСД от 0 до 6,67% см.
ФЕРРИТОМ (Ф) называется твердый раствор углерода в α-железе. У него сохраняется решетка Feα (ОЦК). Феррит занимает на диаграмме узкую область, примыкающую к железу – GPQ. Максимальная растворимость углерода в нем не более 0,02% (точка Р), при комнатной температуре она равна 0,006%. Твердость феррита 65-130 НВ, δ = 40%.
Раствор углерода в высокотемпературном δ-железе называется дельта ферритом. Область устойчивости дельта феррита AHN, концентрация углерода достигает 0,1% (точка Н).
АУСТЕНИТ (А) – твердый раствор внедрения углерода в γ-железе (с решеткой ГЦК). Однофазная область аустенита на диаграмме ограничена линией NJESG. Максимальная растворимость углерода в аустените составляет 2,14% (11470С, точка Е).
ЦЕМЕНТИТ (Ц) – химическое соединение железа с углеродом, соответствующее формуле Fe3C с концентрацией углерода 6,67% (вертикальная линия
DFKL). Температура плавления цементита точно не определена, т.к. при нагревании он легко распадается на аустенит и графит.
Все остальные области диаграммы за исключением перечисленных, являются двухфазными. В двухфазных областях в равновесии находятся: в области АВН – жидкий раствор и кристаллы феррита; HJM – кристаллы феррита и аустенита; JBC – жидкий раствор и кристаллы аустенита; ESECFK – кристаллы аустенита и цементита; QPSKL – кристаллы феррита и цементита.
Горизонтальные линии на диаграмме отвечают равновесным трехфазным состояниям сплавов. В сплавах с концентрацией углерода от 0.1 до 0,51% при температуре 14990С (линия HJB) происходит перитектическое превращение. В результате взаимодействия кристаллов феррита с окружающим жидким раствором образуется аустенит:
 L(B) + Ф(H) A(J).
L(B) + Ф(H) A(J).
Перитектическое превращение в сплавах, расположенных левее точки J (С = 0,1 – 0.16%), идет до исчезновения жидкой фазы, а в сплавах, расположенных правее точки J (С = 0,16 – 0,51%), - до исчезновения феррита.
При температуре 11470С (линия ECF) в сплавах с концентрацией углерода от 2,14 до 6,67% происходит эвтектическое превращение:

 L(С) А(Е) + Ц(F)
L(С) А(Е) + Ц(F)
В процессе превращения жидкий раствор затвердевает в виде механической смеси кристаллов аустенита и цементита, которая называется ледебуритом (Л).
Во всех сплавах системы с концентрацией углерода более 0,02% при температуре 7270С (линия PSK) происходит эвтектоидное превращение, заключающееся в распаде аустенита на дисперсную механическую смесь чередующихся пластинок феррита и цементита, которая называется перлитом (П):

 А(S) Ф(Р) + Ц(К).
А(S) Ф(Р) + Ц(К).
Причиной эвтектоидной реакции является полиморфное превращение Feγ в Feα и резкое уменьшение растворимости углерода с 0,8% в γ-фазе до 0,02% в α-фазе.
Цементит может образовываться из жидкой и твердой фаз при различных температурах. Цементит, выделяющийся из жидкой фазы, называется первичным (ЦI), из аустенита – вторичным (ЦII), а из феррита – третичным (ЦIII).
Железоуглеродистые сплавы при температурах, соответствующих перитектическому, эвтектическому или эвтектоидному превращению находятся в трехфазном равновесном состоянии. Согласно правилу фаз (С = К – Ф + I) равновесие является нонвариантным (С = 2 –3 +I = 0). Все эти превращения происходят при определенных температурах и характеризуются остановкой (горизонтальным участком) на кривой охлаждения сплавов. Во всех остальных областях диаграммы в равновесии находятся две фазы. Эти равновесия моновариантные (С = 2 – 2 + I = I), т.е. превращения в сплавах происходят в интервалах соответствующих температур.
Концентрация углерода в характерных точках диаграммы железо-цементит и линии трехфазного равновесия дана в таблицах 3.1 и 3.2.
Таблица 3.1 – Концентрация углерода в характерных точках диаграммы.
| Индекс линии | Температурный интервал, 0С | Интервал концентраций углерода, % | Основные свойства |
| А | 0,00 | Точка затвердевания чистого железа | |
| В | 0,51 | Состав жидкой фазы при перитектическом равновесии с d-ферритом и аустенитом | |
| С | 4,30 | Состав жидкой фазы при эвтектическом равновесии с аустенитом и цементитом | |
| H | 0,10 | Предельное содержание углерода в d-феррите. Состав феррита при перитектическом равновесии с жидкостью В и аустенитом J | |
| J | 0,16 | Состав аустенита при перитектическом равновесии | |
| Е | 2,14 | Предельное содержание углерода в аустените. Состав аустенита при эвтектическом равновесии с жидкой фазой и цементитом | |
| S | 0,80 | Состав аустенита при эвтектоидном равновесии с ферритом и цементитом | |
| P | 0,02 | Предельное содержание углерода в феррите при эвтектоидном равновесии с аустенитом и цементитом | |
| Q | Комнатная | 0,006 | Предельное содержание углерода в феррите при комнатной температуре |