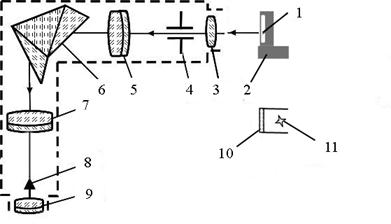
Теоретичний відомості і опис установки
Як відомо спектр кожного газу складається з окремих спектральних ліній або груп (серій) близько розташованих ліній. Найбільш вивченим є спектр атома водню. Частоти випромінювання атома водню можна описати узагальненою формулою Бальмера у вигляді (1):
 , (1)
, (1)
де  - частота випромінювання атома водню при його переході з
- частота випромінювання атома водню при його переході з  -го енергетичного рівня на
-го енергетичного рівня на 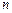 -й енергетичний рівень;
-й енергетичний рівень;  - стала Рідберга;
- стала Рідберга;  і
і 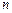 - цілі числа (
- цілі числа (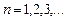 , а
, а  набуває значень
набуває значень
 і т.д.).
і т.д.).
Стала Рідберга  у формулі (1) визначається співвідношенням (2):
у формулі (1) визначається співвідношенням (2):
 , (2)
, (2)
де 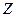 - порядковий номер атома водню (
- порядковий номер атома водню (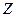 =1); m=9,11·10-31 кг – маса електрона; е=1,6·10-19 Кл – заряд електрона;
=1); m=9,11·10-31 кг – маса електрона; е=1,6·10-19 Кл – заряд електрона; 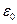 =8,85·10-12 Ф/м – електрична стала; с=3·108 м/с – швидкість світла у вакуумі;
=8,85·10-12 Ф/м – електрична стала; с=3·108 м/с – швидкість світла у вакуумі; 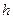 - стала Планка.
- стала Планка.
Кожному значенню 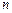 в (1) відповідає серія спектральних ліній. Для видимої частини спектра атома водню
в (1) відповідає серія спектральних ліній. Для видимої частини спектра атома водню 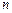 =2.
=2.
Формулу (1) з урахуванням (2) можна записати таким чином:
 . (3)
. (3)
Виражаючи частоту випромінювання  через довжину хвилі
через довжину хвилі 
 з (3) одержуємо вираз для визначення сталої Планка:
з (3) одержуємо вираз для визначення сталої Планка:
 . (4)
. (4)
З врахуванням того, що для атома водню 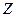 =1 вираз (4) перепишемо у вигляді
=1 вираз (4) перепишемо у вигляді
 . (5)
. (5)
Перехід атомів газу із основного стану в збуджений легко здійснити за допомогою електричного розряду в розрідженому газі. Перехід атомів із збудженого стану в основний проходить спонтанно (самовільно) з випромінюванням ліній усіх серій.
В даній лабораторній роботі визначають наступні лінії в спектрі випромінювання водню, які лежать у видимій частині спектру і становлять 400-600 нм:
· червону лінію  , (
, ( = 3);
= 3);
· зелено-голубу лінію 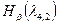 , (
, ( = 4);
= 4);
· фіолетово − синю лінію  , (
, ( = 5);
= 5);
· фіолетову лінію  , (
, ( = 6).
= 6).
Експериментальна установка зібрана на основі монохроматора УМ–2, який використовується як спектроскоп. Оптична схема установки наведена на рис. 1.