Тема 1. Строение атома, периодический закон Д.И. Менделеева
Цели, задачи:
На фактическом уровне получения знаний:
1. Основные положения квантовой механики, квантово-механическая модель атома, квантовые числа;
2. Понятие электронной орбитали, основные правила и принципы заполнения электронами атомных орбиталей;
3. Электронные формулы атомов, электронно-графические схемы;
4. Распределение химических элементов по электронным семействам;
5. Периодический закон Д.И. Менделеева, структура периодической системы элементов.
На операционном уровне получения знаний:
Обучить студента:
1. Записывать полную электронную формулу атома любого химического элемента;
2. Описывать набором четырех квантовых чисел любой электрон в атоме на основании приведенной электронной формулы;
3. Распределять электроны по квантовым ячейкам в электронно-графической схеме.
На аналитическом уровне получения знаний:
Обучить студента:
1. По приведенной электронной формуле атома определять энергетическое состояние атома (нормальное, возбужденное или запрещенное);
2. Определять электронейтральное или ионное состояние описывает данная электронная формула;
3. По электронной формуле валентной структуры атома указывать местоположение данного химического элемента в периодической системе (период, группа, подгруппа) возможные его степени окисления;
4. Определять, к какому электронному семейству элементов относится данный элемент и правильно назвать его электронные аналоги.
Фактический материал:
I. Краткое изложение основных положений квантовой механики: а) квантованность энергии; б) корпускулярно-волновой дуализм электрона, уравнение де Бройля (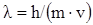 ; в) понятие орбитали и волновой функции, физический смысл квадрата волновой функции
; в) понятие орбитали и волновой функции, физический смысл квадрата волновой функции 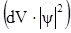 ; г) энергетическое описание электрона в атоме набором четырех квантовых чисел (привести возможные значения и физический смысл каждого квантового числа).
; г) энергетическое описание электрона в атоме набором четырех квантовых чисел (привести возможные значения и физический смысл каждого квантового числа).
II. Основные правила и принципы распределения электронов по электронным орбиталям в многоэлектронных атомах: а) принцип минимума энергии, правила Клечковского; б) принцип Паули; в) правило Хунда. Электронная формула атома (полная и формула валентной структуры). Понятие квантовой электронной орбитали (квантовой ячейки), графическое изображение электронной оболочки атома при помощи энергетической диаграммы – электронно-графической схемы.
III. Структура периодической системы элементов. Электронные семейства химических элементов. Распределение химических элементов по периодам, группам и подгруппам согласно структуры их электронных оболочек (s-, p-, d-, f- элементы). Понятие электронных аналогов. Краткая характеристика общих основных химических свойств элементов (окислительно-восстановительных и кислотно-основных) по электронным семействам. Понятие потенциала ионизации и сродства к электрону и изменение этих характеристик элементов в периодической системе. Современная формулировка периодического закона Д.И. Менделеева.
Выводы по теме:
1. Атом сложная система, химические свойства которой определяются структурой ее электронной оболочки.
2. Распределение электронов в атоме подчиняется принципам и правилам квантовой механики.
3. Периодически повторяющиеся с возрастанием заряда ядра атомов однотипные электронные конфигурации атомов лежат в основе периодического закона и определяют структуру периодической системы элементов.
Вопросы для самопроверки:
1. Указать элемент, которому соответствует электронная формула атома 1s22s22p63s23p63d104s24p2:
а) Са; б) Zn; в) Ge.
2. Указать полное число электронов в атоме, валентная структура которого имеет формулу 3d104s2:
а) 30; б) 18; в) 20.
3. Для атома с массовым числом 36 а.е.м. и порядковым номером 17 в периодической системы укажите число протонов (р) и нейтронов (n) в ядре и число электронов (е) в электронной оболочке нейтрального атома:
а) р=17, n=19, е=17; б) р=19, n=17, е=17; в) р=17, n=17, е=17.
4. Изотопы какого элемента (Ni, Zn, Si) имеют в ядре соответствующее количество протонов (р) и нейтронов (n):
а) р=14, n=14; б) р=14, n=15; в) р=14, n=16?
5. Сколько неспаренных электронов имеет атом марганца Mn в основном состоянии:
а) 7; б) 5; в) 2.
6. Атом какого элемента в основном состоянии содержит три свободных 4d орбитали:
а) Sc; б) V; в) Zr?
7. Учитывая правило Хунда, определить, атому какого элемента соответствует электронная конфигурация валентной структуры 1s22s22p63s13p3 в высшем энергетическом состоянии:
а) P; б) As; в) Si.
8. Гидроксид какого элемента: Na, Mg или Al является более сильным основанием:
а) Na; б) Mg; в) Al.
9. Гидроксид какого элемента: алюминия 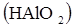 , кремния
, кремния 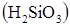 или фосфора
или фосфора  является более сильной кислотой:
является более сильной кислотой:
а) Al; б) Si; в) P.
10. Значения первых потенциалов ионизации элементов I группы периодической системы соответственно равны (в вольтах): Li (5,4); Cu (7,7); Ag (9,2). Указать, у какого элемента металлические свойства выражены сильнее:
а) Li; б) Cu; в) Ag.